导读
最近的研究揭示了肠道真菌群落在人类健康中的重要作用。本研究调查了来自欧洲人群的受试者肠道真菌菌群的含量和变化。探索了肠道真菌与各种与宿主相关的社会人口统计学、生活方式、健康和饮食因素之间的相互作用。这项研究包括923名参与者。粪便DNA样本采用宏基因组高通量测序分析。随后,确定了真菌的分类特征,并对其与53个宿主相关因子的相关性进行了计算和统计分析。真菌群落以Saccharomyces、Candida和Sporisorium为主。发现10个因素与整体真菌菌群变异显著相关。大多数与饮食有关,包括薯片、肉类、苏打水、甜味剂、加工食品和酒精的消费,其次是年龄和婚姻状况。其他因素,如身体质量指数(BMI)、工作类型、自身免疫性疾病和益生菌也影响α/β多样性。差异丰度分析显示,真菌种类在特定条件下表现出不同的变化模式。人类肠道真菌菌群以酵母菌为主,包括Saccharomyces、Malassezia和Candida。尽管志愿者间的差异很大,但在大多数样本中仍有几种真菌物种存在,这可能是存在核心肠道真菌菌群的证据。此外,本研究发现与宿主相关的因素,如饮食、年龄和婚姻状况影响肠道真菌菌群的变异性。
论文ID
原名:Host Factors Associated with Gut Mycobiome Structure
译名:与肠道真菌菌群结构相关的宿主因子
期刊:mSystems
IF:7.324
发表时间:2023.2
通讯作者:Anna Philips
通讯作者单位:波兰科学院生物有机化学研究所
DOI号:10.1128/msystems.00986-22
实验设计
结果
1. 肠道真菌菌群变异
本研究从波兰志愿者收集的923份粪便样本中鉴定了肠道真菌群落。每位参与者都完成了一份详细的医疗、生活方式和饮食问卷。为了表征粪便微生物群中的真菌谱系,我们从粪便中提取DNA,并使用NextSeq 550进行全宏基因组高通量测序(下一代测序[NGS])。88.1%的受试者(813个样本)检测到了真菌,并对这些样本进行了进一步分析。共检出55种,隶属于20科、12目、9纲、2门、37属。子囊菌门为优势门(94.0%),担子菌门占40.0%。最常见的属是Saccharomyces和Sporisorium,存在于59.0%的样本中。在种水平上,最常见的物种是Saccharomyces cerevisiae(58.8%的样品中存在),其次是Candida albicans和Sporisorium graminicola(分别存在于31.6%和23.4%的样品中)。被调查样品的整体真菌菌群结构如图1B所示。单个粪便样品的真菌丰富度较低,平均含有2.77种不同的真菌种类,单个样品中鉴定出的最大菌种数为11种。真菌物种共存的聚类表明,一些物种常与其他物种共存(图1C)。作为人类肠道菌群中的优势真菌物种(存在于58.79%的样本中),S. cerevisiae单独聚类。C. albicans、Debaryomyces hansenii和S. graminicola在样品中最常见(分别占31.61%、23.37%和14.76%)。虽然除S. cerevisiae外,这些真菌在不到50%的个体中被发现,但S. cerevisiae和这些真菌可能作为人类肠道中的核心真菌微生物群。Aspergillus fumigatus、Talaromyces rugulosus、Aspergillus oryzae、Saccharomyces paradoxus、Candida dubliniensis、Malassezia restricta、Zygotorulaspora mrakii、Ustilago maydis和Yarrowia lipolytica构成另一个独特的聚类。在该聚类中,样品中真菌发现频率中等(平均频率为8.91%;样本的最大频率和最小频率分别为12.55%和4.06%)。聚类还显示了其他三个类群,主要是在测试样本中发现的真菌,且频率较低。相关性分析显示,许多物种之间存在显著相关关系(图2)。其中大部分为正相关,只有少数为负相关。值得注意的是,在酵母菌属中,Saccharomyces物种与C. dubliniensis之间,T. rugulosus与D. hansenii、Pochonia chlamydosporia、Thermothelomyces thermophilus、Cercospora beticola和Aspergillus物种之间观察到正相关最强。在A. fumigatus和A. oryzae中可以观察到相同的相关性。C. albicans、U. maydis、S. cerevisiae和Colletotrichum higginsianum之间以及S. graminicola、Saccharomyces eubayanus和S. paradoxus之间存在显著负相关。
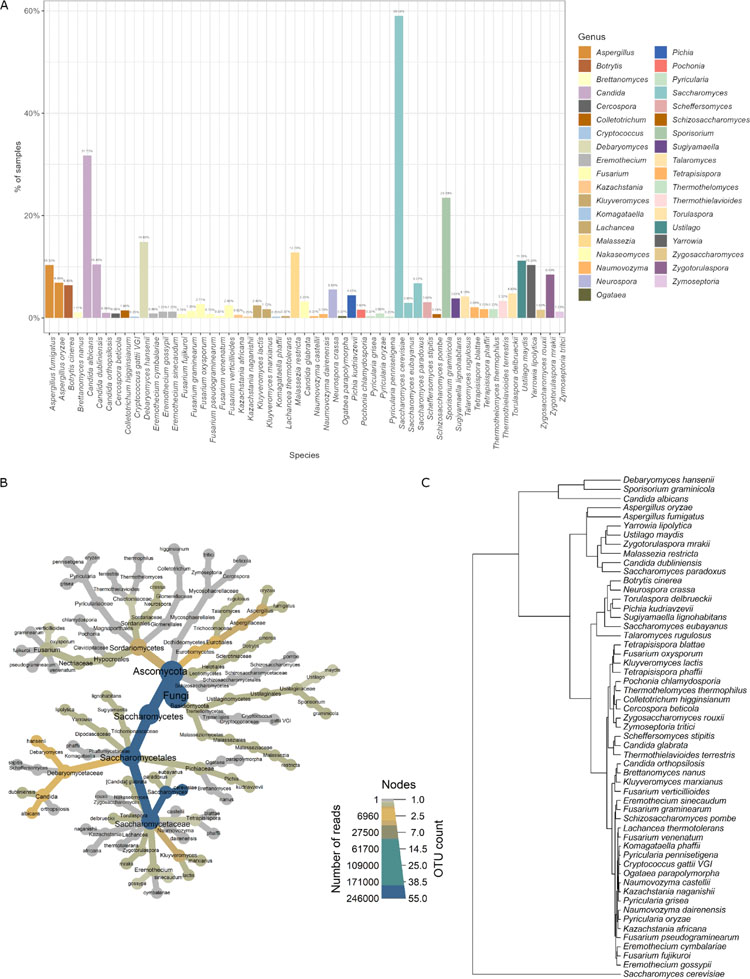
图1 样品中真菌菌群的变化。(A)粪便样本中真菌种类的总体流行率。百分数表示鉴定到某一特定物种的样本数量;(B)肠道样本的整体真菌菌群结构。节点的大小是根据给定分类水平上不同操作分类单元(OTUs)的数量来设置的;(C)基于真菌种类在样本中的频率绘制树状图。
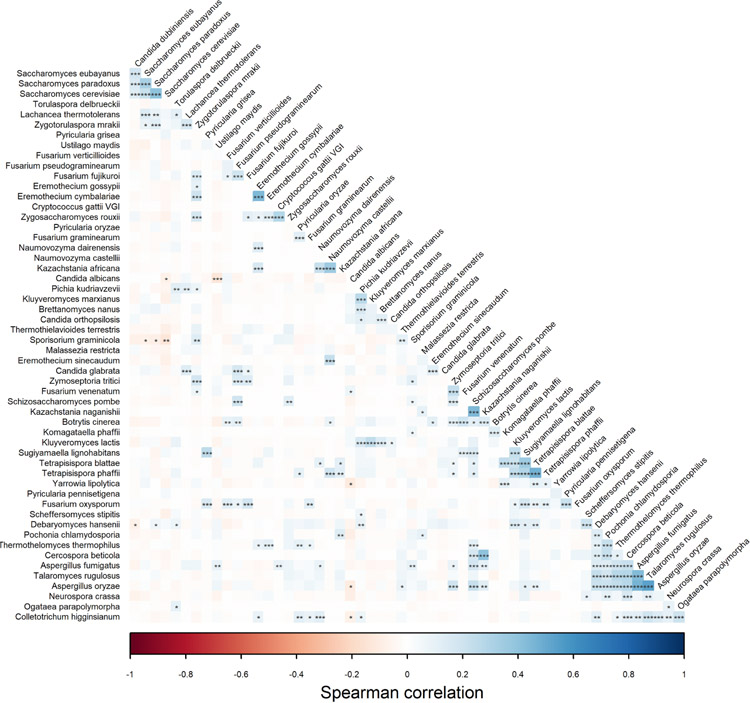
图2 物种之间的联系。采用Spearman计算两两相关性,采用FDR校正的t检验估计其显著性。***P = 0.001,**p = 0.01,*P = 0.05。
为了确定与肠道真菌菌群组成显著相关的因素,本研究测试了53个受试者数据变量。发现有10个因素与受试者的整体真菌菌群变异相关(P<0.05;图3A)。其中,饮食相关因素包括薯片、肉类和苏打水的摄入以及饮酒频率是肠道真菌菌群的前四个协变量。接着是糖(甜味剂)、加工食品的消费量和年龄因素。有趣的是,在受试者中,单身也被检测出与肠道真菌菌群变化显著相关。导致真菌菌群变化的最后两个因素是饮酒和喝啤酒。总体而言,所有这些具有统计学意义的受试者数据变量解释了14.54%的真菌菌群变异(图3B)。工作相关因素以及抗生素、益生菌、补充剂和药物均未与肠道真菌组成显著相关(P>0.05)。本研究还进行了真菌属与调查数据之间的相关性分析。分析发现,真菌属与不同因素存在轻度相关性,与疾病流行率和饮食相关因素有关(P<0.05;图3C)。关联模式因特定因素的不同而有很大差异。可以观察到几种具有统计学意义的中度相关性:Nakaseomyces、Neurospora、Sporisorium与抑郁症,Aspergillus、Candida、Fusarium、Talaromyces、Yarrowia与自身免疫性疾病,Nakaseomyces、Sporisorium与高血压,Ustilago与胃灼热,Botrytis、Fusarium与肠易激综合征以及Ustilago与反流。饮食因素与Botrytis和Fusarium呈中度相关。在与饮食相关的因素中,甜味剂(Candida)、盐(Candida、Debaryomyces、Pyricularia、Tetrapisispora)、薯片(Brettanomyces、Candida、Colletotrichum、Debaryomyces、Nakaseomyces、Thermothielavioides、Yarrowia)、咖啡(Candida、Debaryomyces、Eremothecium、Naumovozyma)、鱼类(Candida、Malassezia、Thermothielavioides)、液体(Debaryomyces、Saccharomyces)、泡菜(Cercospora、Debaryomyces、Pochonia、Scheffersomyces、Talaromyces)、茶(Debaryomyces、Malassezia、Scheffersomyces)、蔬菜(Candida)和饮酒(Zygotorulaspora)存在中度相关性。有趣的是,睡眠与一些真菌属有关,如Talaromyces、Tetrapisispora和Thermothielavioides。
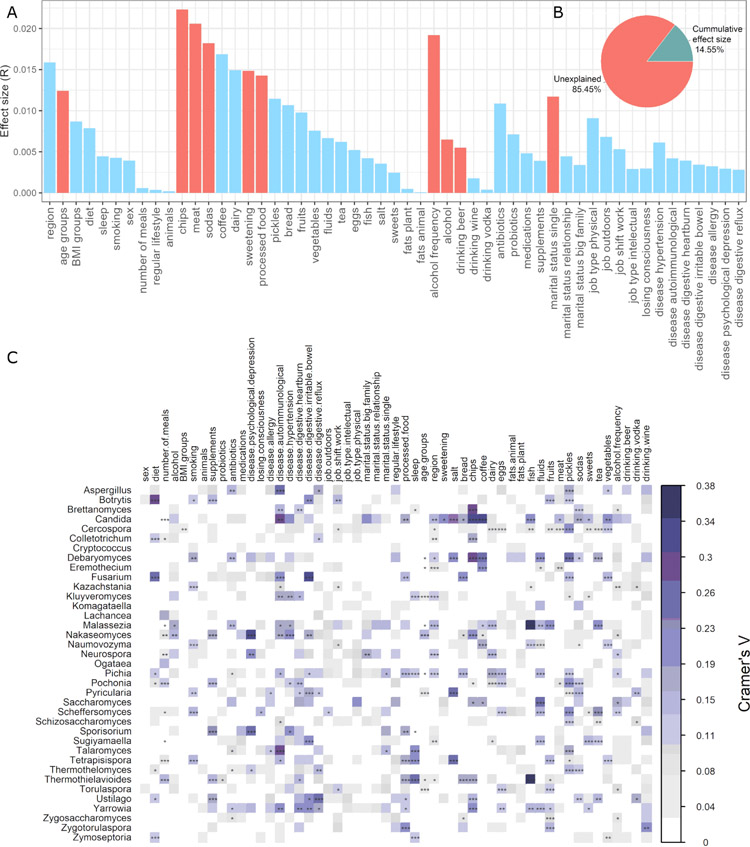
图3 宿主因子及其对肠道真菌菌群变异的影响。(A)受试者数据变量在人体肠道真菌群落变异中的效应量。通过envfit鉴定真菌菌群协变量,具有统计学意义(FDR校正P<0.05)的协变量用红色表示。(B)饼状图显示了显著的受试者数据变量所解释的微生物变异的比例。(C)肠道真菌菌群与调查因子之间的关系。
为了研究饮食相关因素对宿主真菌菌群的影响,将795个具有适当的参与者饮食数据的样本分为4组,分别反映受试者的一般饮食类型:多样型、其他型、纯素型和素食型(n=730,n=28,n=5和n=32)。经统计学分析,各组间真菌物种丰富度存在差异(Kruskal-Wallis秩和检验,P <0.001)。素食者的肠道真菌丰富度明显高于饮食多样化或其他类型的受试者(P<0.05;图4A)。同样,Shannon多样性分析也揭示了饮食组之间的差异(P<0.001)。素食者的Shannon多样性显著高于饮食多样化或其他饮食类型的受试者(P<0.05,图4B)。真菌菌群的差异丰度分析显示,在特定类型饮食的受试者中,许多真菌物种的丰度存在差异(P<0.05)。与多样化饮食类型相比,素食者具有显著较高丰度的A. oryzae和S. paradoxus,而Neurospora crassa丰度较低。纯素食者有较高丰度的Botrytis cinerea、Y. lipolytica、U. maydis、S. graminicola、A. oryzae、S. paradoxus、N. crassa和M. restricta,而Z. mrakii、A . fumigatus、C. dubliniensis、D. hansenii和S. cerevisiae丰度较低。其他类型饮食的受试者中,B. cinerea、N. crassa、Y. lipolytica和A. oryzae的丰度显著较高,而S. paradoxus、M. restricta、Z. mraki、S. graminicola和C. dubliniensis的丰度较低。对纯素食者和素食者的比较表明,这种差异部分类似于纯素食者和多样化饮食类型的受试者之间的差异。纯素食者有较高丰度的B. cinerea、S. graminicola、U. maydis和Y. lipolytica,而D. hansenii、M. restricta、A. fumigatus、C. dubliniensis、C. albicans和S. cerevisiae丰度较低。在纯素食者和其他饮食类型的受试者之间,纯素食者的U. maydis和C. albicans丰度略高,而A. fumigatus、D. hansenii和S. cerevisiae的丰度较低。素食者中Y. lipolytica、S. graminicola和B. cinerea的丰度较高,而C. dubliniensis、M. restricta和Z. mrakii的丰度较低。对于甜味因素,该分析并没有揭示甜味组和非甜味组之间在丰富度、Shannon和Pilou多样性方面的显著差异。然而,对不同甜味的方差分析显示,各组之间的β多样性有统计学差异(P=0.016,R2=0.002)。差异丰度分析显示,甜味组中C. dubliniensis和S. paradoxus的丰度更高。在不吃肉的受试者中,真菌Shannon多样性明显高于声称每周吃肉一到两份(一份等于150克)、每周吃七到八份和每周吃九份以上的受试者(P<0.05)。真菌菌群的差异丰度分析显示,在不同肉类摄入量的受试者中,两种真菌的丰度不同。除了吃3~4份肉的受试者外,几乎所有食用肉类的群体中,N. crassa和S. paradoxus的丰度都高于不食用肉类的受试者,其中N. crassa的对数倍数变化为正,而S. paradoxus的对数倍数变化为负,尽管负对数倍数变化相对较小。尽管薯片、苏打水和加工食品因素与肠道真菌菌群组成显著相关,但在所有分析数据中,分析各组之间的丰富度、Shannon多样性、Pilou多样性和β多样性在统计学上没有显著差异。每日饮用苏打水超过2 L的受试者,S. cerevisiae的丰度显著高于不饮用苏打水的受试者,而B. cinerea、Y. lipolytica、N. crassa和A. oryzae的丰度略低。饮用1.5-2.0 L苏打水的受试者与不饮用苏打水的受试者相比,观察到A. oryzae含量的正对数倍数变化,而在饮用2.0 L以上苏打水和不饮用苏打水的受试者的比较中,可以观察到类似物种的负变化,唯一的区别是Z. mraki取代了A. oryzae。当苏打水摄入量减少到每天1.0~1.5 L时,C. dubliniensis、S. paradoxus和A . oryzae的丰度升高,B. cinerea、M. restricta、N. crassa和Z. mrakii的丰度降低。在食用薯片的情况下,每周食用5份以上薯片(一份等于30克)的受试者与不食用薯片人群相比,其体内的S. paradoxus、C. dubliniensis、U. maydis、M. restricta和Y. lipolytica丰度更高,而Z. mrakii、N. crassa、B. cinerea、A. oryzae、D. hansenii、A. fumigatus和S. graminicola丰度较低。这种差异随着薯片摄入量的减少而消失,每周食用3-4份薯片的受试者与不食用薯片的受试者之间的差异仅在于Z. mrakii的减少。只有经常(一周几次)食用加工食品才会影响肠道真菌菌群的结构。每周食用加工食品的受试者体内N. crassa的丰度明显较高,而A. oryzae的丰度则较低。
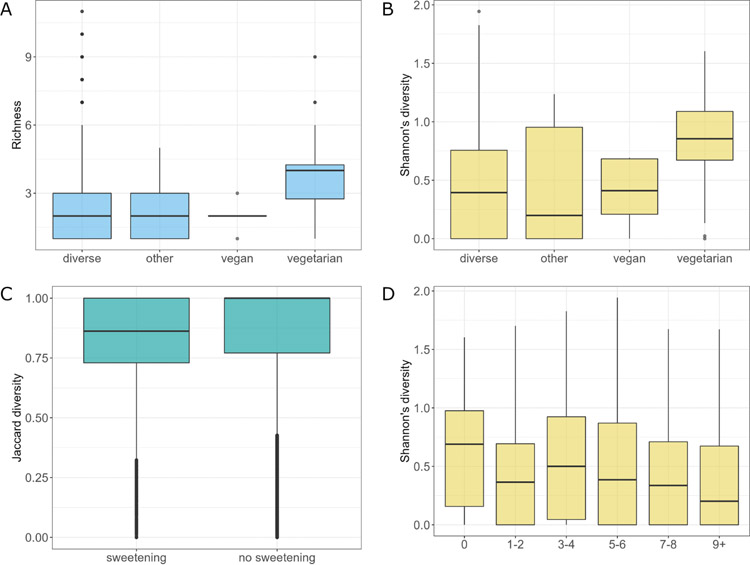
图4 不同饮食条件下真菌菌群的特征。(A)与饮食类型相关的群落丰富度;(B)与饮食类型相关的真菌菌群Shannon多样性;(C)甜味因素的β多样性;(D)摄入肉类对Shannon多样性的影响。
饮酒是与肠道真菌菌群组成显著相关的另一个因素。分析显示,饮酒与不饮酒的受试者在Pilou多样性方面存在显著差异(P=0.036)。饮酒的受试者真菌菌群多样性较低(图5A)。此外,方差分析显示饮酒和不饮酒的受试者之间的β-多样性有统计学差异(P=0.011,R2=0.003;图5B)。此外,饮酒的受试者比不饮酒的受试者具有明显更高丰度的S. cerevisiae。值得注意的是,这可能是摄入酒精的直接影响,因为S. cerevisiae被广泛认为参与啤酒和葡萄酒的酿造过程。饮酒频率分析显示,不同饮酒模式(很少、每天、每月、每周,Kruskal-Wallis秩和检验,P=0.007)之间的丰富度存在差异。每日和每周饮酒的受试者真菌种类丰富度显著高于每月饮酒的受试者(P=0.048,P=0.033)。有趣的是,只有每日饮酒才会影响肠道菌群结构。与很少饮酒和每月饮酒的受试者相比,频繁(每日)饮酒的受试者中Z. mrakii和A. fumigatus的丰度显著升高,B. cinerea、M. restricta、Y. lipolytica、U. maydis、A. fumigatus和S. graminicola的丰度显著降低。在测试的酒精类型(葡萄酒、啤酒和伏特加)中,只有饮用葡萄酒的受试者真菌物种丰富度显示出显著差异(P=0.006,图5D)。喝葡萄酒的受试者和不喝葡萄酒的受试者之间的β多样性差异也很显著(P=0.022,R2=0.003,图5E)。然而,真菌菌群的差异丰度分析不能揭示对任何分析的酒精类型的测试组之间的物种差异。
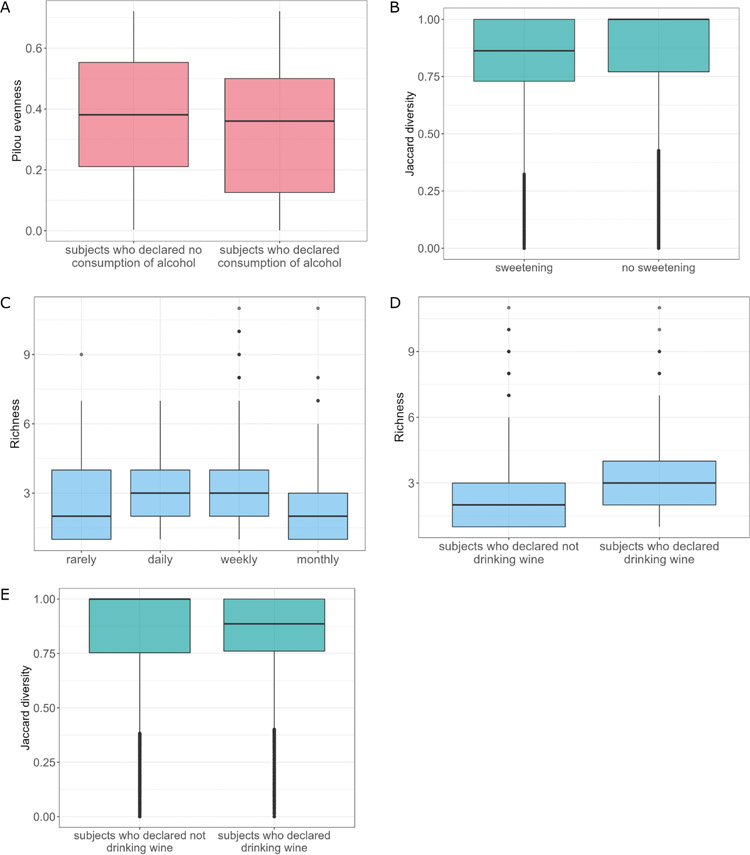
图5 不同酒精条件下真菌菌群特征。(A)关于受试者酒精消费因素分析的群落Pilou均匀度;(B)摄入酒精对β多样性的影响;(C)受试者真菌群落的丰富度与摄入酒精频率相关;(D)受试者真菌群落的丰富度与饮酒因素有关;(E)饮葡萄酒对β多样性的影响。
根据受试者的年龄将806个样本分为四组,≤25岁、26-45岁、46-65岁和>65岁(n=183、n=484、n=110和n=30)。分析显示各组间Shannon多样性存在差异(P=0.036)。46-65岁组的Shannon多样性与≤25岁和26-45岁组相比有显著差异(P=0.038和P=0.038):46-65岁组的Shannon多样性平均水平显著较高(图6A)。各组β多样性也存在差异(P=0.001,R2=0.008),26-45岁vs 46-65岁、≤25岁vs 46-65岁组差异显著(P=0.012和R2=0.005)(表1,图6B)。差异分析显示,在46-65岁与≤25岁之间,S. graminicola和S. paradoxus丰度发生变化。此外,在46-65岁和26-45岁组的比较中,也检测到S. paradoxus和S. cerevisiae的丰度较低。虽然非参数比较检验在其他年龄组的比较中没有显示出显著差异,但真菌菌群的差异分析也揭示了不同年龄组之间物种的丰度差异。与65岁以上的受试者差异最大,与>65岁组相比,26-45岁受试者中Z. mrakii、A. fumigatus、Y. lipolytica、C. dubliniensis、A. oryzae、B. cinerea和N. crassa的丰度较高。25岁以下和65岁以上受试者的真菌种类差异相似,除A. oryzae和B. cinerea为负对数倍数变化外,还伴有S. paradoxus。与65岁以上的受试者相比,在26-45岁组中可以观察到几乎相同的差异模式,唯一的例外是N. crassa,在这种情况下,它也有负的倍数变化值。在宿主性别方面,男性微生物群落的同质性低于女性微生物群落,这可以从Pilou多样性的比较中看出(P=0.021,图6C)。
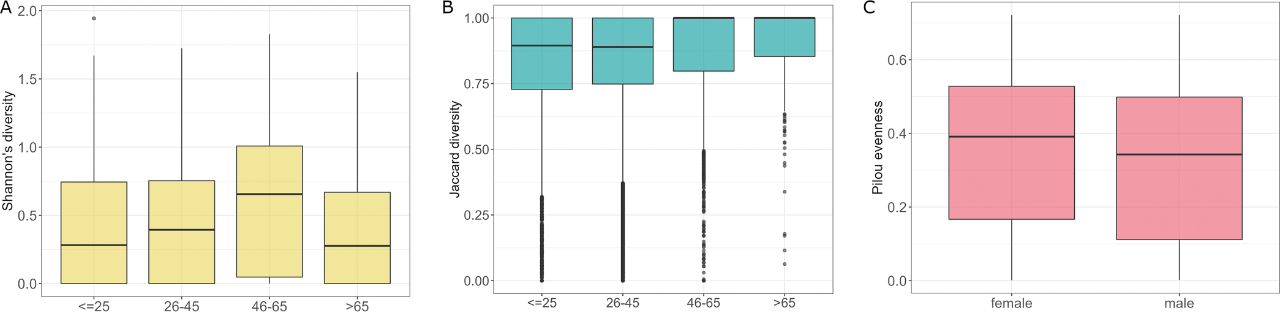
图6 不同年龄组的真菌菌群特征。(A)真菌群落在不同年龄分组的Shannon多样性;(B)年龄分组的β多样性分析;(C)真菌群落在宿主性别方面的均匀度。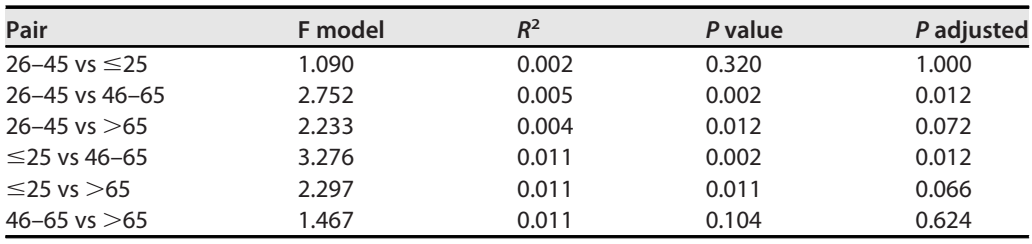
根据提供的身高和体重计算了756名受试者的BMI。接下来,根据受试者的BMI将样本分为四组,包括体重过轻(BMI≤8.5,n=41)、正常(18.5≤BMI≤25,n=422)、超重(25≤BMI≤30,n=233)和肥胖(BMI≥30,n=61)。分析显示各组间真菌物种丰富度存在差异(P=0.0346)。然而,真菌Shannon多样性在各组间无显著差异。相比之下,BMI组的Pilou均匀度指标有显著差异(P=0.013),超重受试者的真菌菌群同质性明显低于体重过轻和正常受试者(P=0.029和P=0.041)。差异分析揭示了不同组间真菌种类的变化模式。与正常体重相比,低体重受试者S. paradoxus和Z. mrakii丰度较高,A. oryzae、D. hansenii、N. crassa、Y. lipolytica和U. maydis丰度较低。肥胖组的A . oryzae丰度略高于正常组,B. cinerea、Z. mraki、A. fumigatus与正常组相比有负对数倍数变化。低体重与肥胖受试者在Z. mrakii、D. hansenii、A. oryzae、Y. lipolytica、N. crassa、S. paradoxus和U. maydis的丰度上存在差异。二者的较低丰度物种也相似,如D. hansenii、Y. lipolytica、N. crassa和U. maydis。此外,三种物种,B. cinerea、S. paradoxus、A. fumigatus在肥胖和低体重受试者中丰度更高。肥胖和低体重受试者之间的差异与肥胖和正常受试者之间的差异相同。
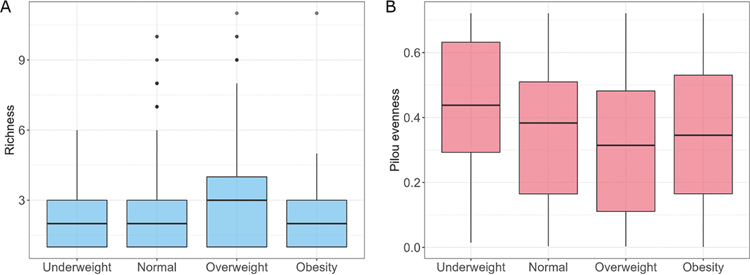
图7 不同BMI组的真菌菌群特征。(A)真菌群落在BMI分组的丰富度;(B)真菌群落在BMI分组的均匀度。
7. 活方式对肠道真菌菌群的影响
户外工作因素方差分析显示各组间β多样性有显著差异(P=0.004,R2=0.003;图8A)。然而,真菌菌群的差异丰度分析无法揭示在户外工作受试者数据中测试组之间的不同物种。处于恋爱关系中的受试者比没有恋爱关系的受试者表现出更少的同质性真菌群落(P=0.015;图8B)。此外,婚姻状况单因素方差分析显示各组间β多样性有显著差异(P=0.015,R2=0.002;图8C)。单身受试者间有更强的同质性真菌群落(P<0.001;图8D),他们的S. cerevisiae丰度也明显低于非单身受试者。
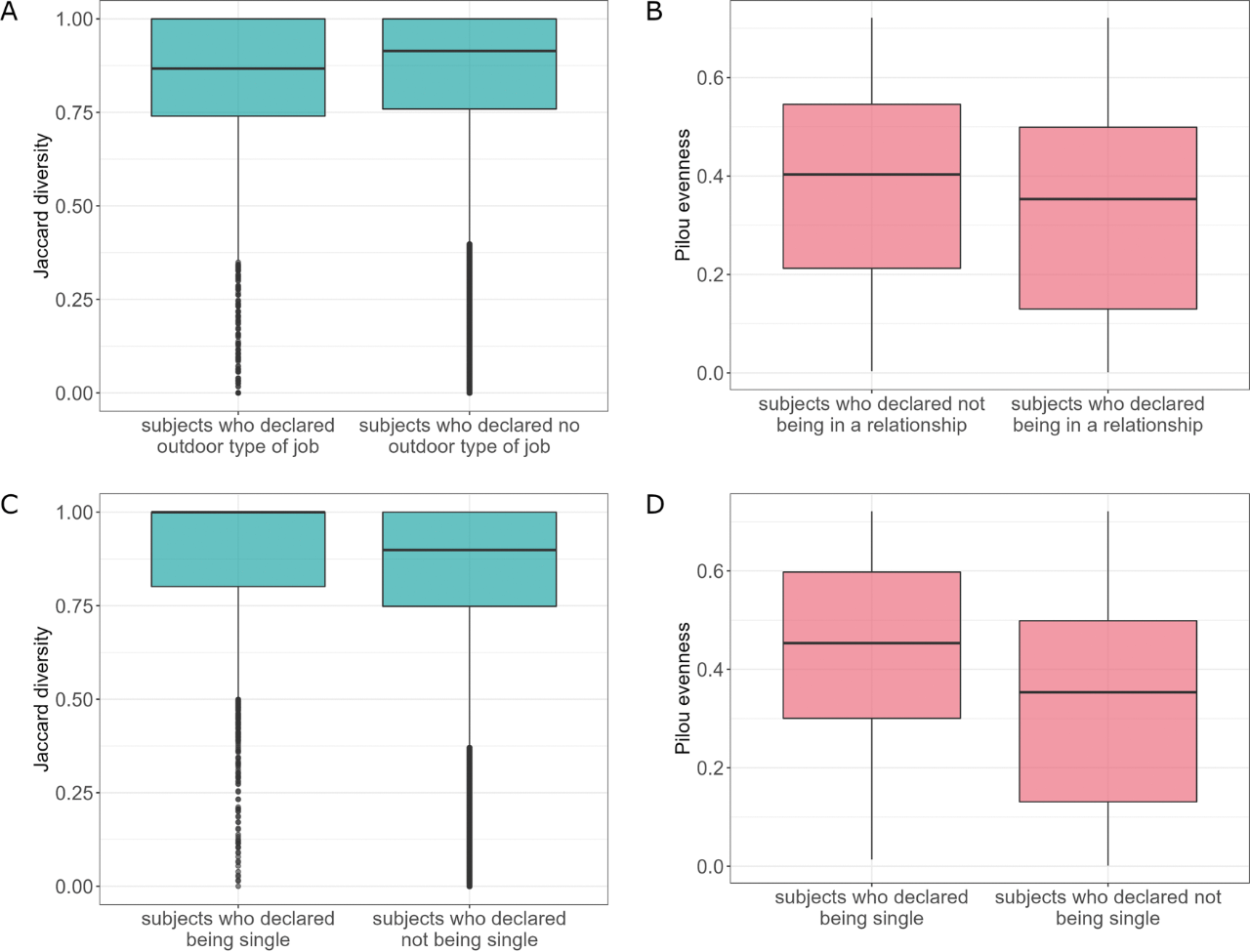
图8 考虑生活方式的真菌菌群特征。(A)户外工作因素的β多样性;(B)真菌群落在婚姻状况关系因素方面的均匀度;(C)婚姻状况的β多样性;(D)真菌群落均匀度。
在所分析的疾病中,只有自身免疫性疾病影响受试者真菌菌群的整体组成。自身免疫性疾病受试者的真菌物种丰富度和Shannon多样性更高(P=0.020,P=0.005;图9A)。此外,自身免疫性疾病受试者的D. hansenii丰度明显较低。在反流、肠易激、胃灼热和抑郁症中也发现了真菌菌群的微妙变化。有反流的受试者体内S. paradoxus、N. crassa和Z. mrakii的丰度较低。N. crassa、Z. mraki、C. dubliniensis、A. oryzae、M. restricta和A. fumigatus的丰度在肠易激中也有所下降,在胃灼热的受试者中也检测到较低丰度的A. oryzae。抑郁症受试者的几种真菌菌群多样性发生了变化,包括N. crassa、B. cinerea、U. maydis、S. paradoxus、M. restricta和A. oryzae丰度上升,Z. mrakii和A. fumigatus丰度下降。
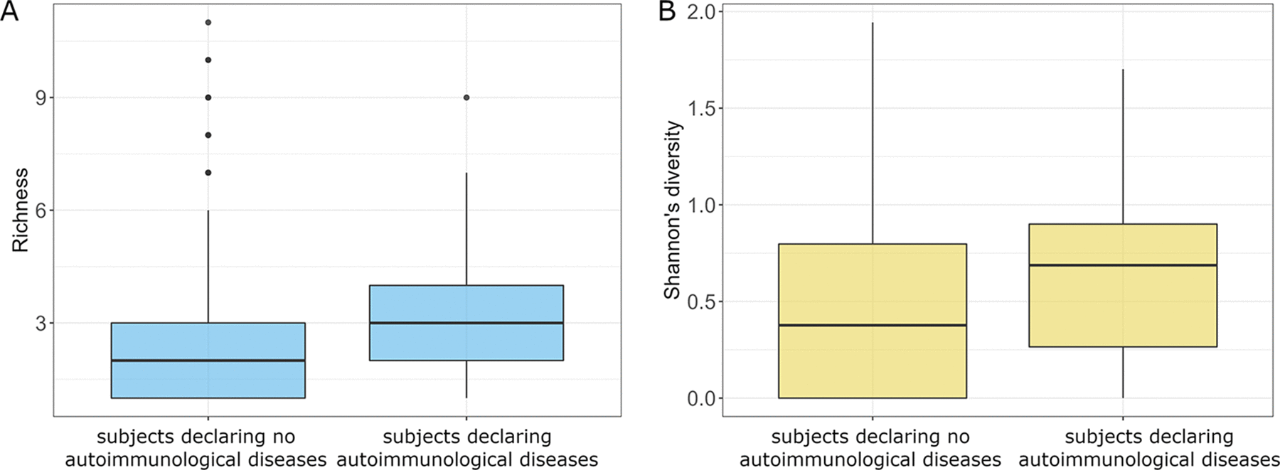
图9 有和没有自身免疫性疾病受试者的比较。(A)真菌群落的丰富度;(B)真菌群落的Shannon多样性。
益生菌会影响肠道真菌物种丰富度(P=0.037)。每天服用益生菌的受试者的肠道真菌菌群的丰富度和Shannon多样性明显低于仅按处方服用益生菌的受试者(P=0.028,P=0.046;图10A,B)。每天服用益生菌的受试者肠道真菌菌群的Shannon多样性也显著低于不服用益生菌的受试者(P=0.048;图10B)。各组间方差分析表明,每天服用益生菌的人群中S. paradoxus、N. crassa、C. dubliniensis、Y. lipolytica、B. cinerea、Z. mrakii和A. fumigatus的丰度显著高于对照组,而U. maydis、M. restricta、S. graminicola、A. oryzae和D. hansenii的丰度显著低于未服用益生菌的受试者。与益生菌相反,补充剂不会影响真菌菌群。不同的抗生素摄取方案不影响真菌丰富度、Shannon多样性、Pilou多样性和β多样性。尽管如此,差异丰度分析表明抗生素可能会影响真菌菌群结构。与近期服用抗生素的受试者相比,未使用抗生素的受试者M. restricta、N. crassa、U. maydis和C. dubliniensis的丰度较高,而Z. mrakii、S. paradoxus和A . oryzae的丰度较低。一年多前服用抗生素与最近服用抗生素相比,B. cinerea和M. restricta的丰度更高,在检查前6至12个月服用抗生素的受试者也有较高的M. restricta丰度,但Y. lipolytica和S. paradoxus丰度较低。比较最近服用抗生素的受试者和半年内服用抗生素的受试者之间的真菌菌群结构,后者的Z. mrakii、N. crassa、A. fumigatus和A. oryzae的丰度较低。对药物和补充剂的分析没有揭示真菌丰富度、Shannon多样性、Pilou多样性和β多样性水平的差异。此外,差异分析也没有发现测试组之间存在差异的物种。
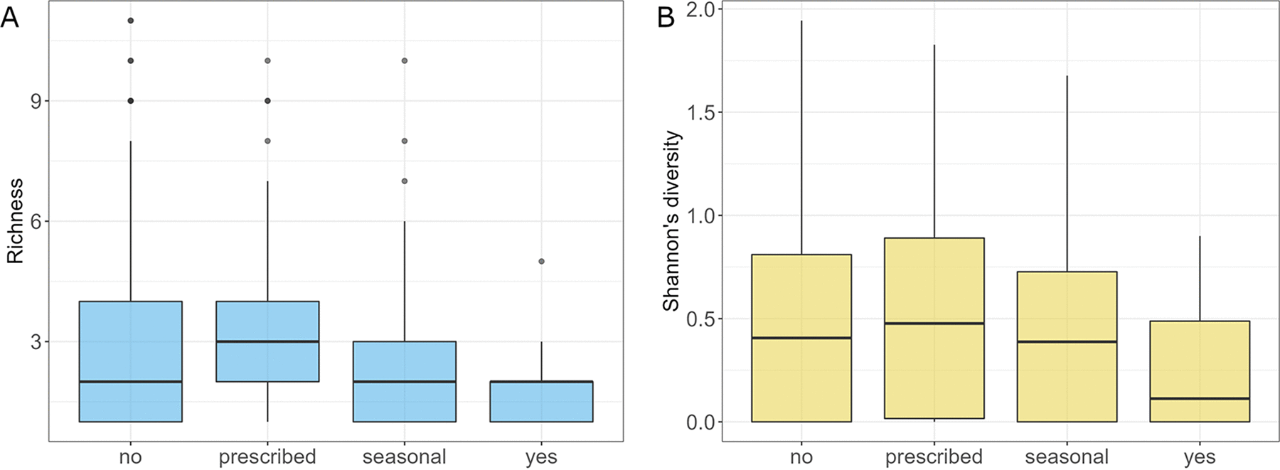
图10 受试者对益生菌的摄取情况。(A)分析组的丰富度;(B)真菌群落的Shannon多样性。
讨论
本研究不仅在分类单元方面,而且最显著的是在广泛的宿主相关背景下,包括广泛的因素,如年龄、BMI、长期饮食习惯、健康和生活方式,探究人类肠道真菌菌群。据我们所知,这是第一个在肠道真菌菌群与如此全面的宿主相关因素的关联方面进行分析的大型欧洲队列。这些数据强调了肠道真菌菌群与人群特征(年龄、BMI、饮食、生活方式等)相结合对宿主健康的重要性。本研究广泛的数据集提供了肠道真菌组成与生活方式和宿主健康相关的基本特征,这可能在饮食和临床干预中有用。与宿主相关的因素,如饮食、年龄和婚姻状况,在真菌菌群变异中表现出实质性的影响。这些数据表明,其他目前未知的元素和内在的微生物生态因素在很大程度上影响着真菌菌群的变化。虽然抗生素的作用不显著,但对种群真菌菌群变异的效应量为1.5%。核心真菌菌群。与细菌群落相比,人类肠道真菌菌群的数量较低(占所有微生物群的1%),多样性也较低。子囊菌门和担子菌门是优势门,这与之前的报道一致,也表明子囊菌的长期稳定性。与其他研究相似,肠道真菌菌群以酵母菌为主,包括Saccharomyces、Malassezia和Candida。人类肠道中Saccharomyces和Candida的流行率与早期的报道一致,而Sporisorium属以前没有被描述为人类肠道微生物群的成员。尽管我们队列中的受试者间变异很高,虽然没有跟踪肠道真菌菌群随时间的变化,但一些真菌物种在许多样本中持续存在的事实,可能支持了核心肠道真菌菌群存在的假设。其中S. cerevisiae、C. albicans和S. graminicola的检出率较高(分别为58.79%、31.61%和23.37%)。尽管在研究期间分析的样本中,C. albicans和S. graminicola存在于不到一半的样本中,但考虑到通过宏基因组方法在人类粪便样本中检测到的真菌物种数量较少,而肠道细菌种类繁多,它们可能与S. cerevisiae一起形成了核心的肠道菌群。值得注意的是,特定真菌种类的检测频率也可能受到基于粪便样本间接估计肠道中存在的物种丰度的影响,可能导致低估存在于肠道粘膜内表面的真菌群落的丰度。其中,S. cerevisiae可广泛存在于环境和食物中,这表明人类肠道中真菌的潜在来源,并反映出人类健康可能受到环境和饮食的外在影响。另一方面,C. albicans是一种经常在健康人体粪便中检测到的真菌,它似乎没有主要的外界生存环境,这表明它与宿主和同定殖微生物共同进化。值得注意的是,植物病原菌S.graminicola作为人类肠道的组成成分,在此之前并没有报道。我们也不能排除S. graminicola在我们的分析或其他类似研究中由于所使用的方法的限制而没有正确识别的可能性。C. albicans可被认为是一种机会致病菌。它是人类肠道菌群的正常组成部分,但它也可以定植多个其他身体部位(例如,口腔、皮肤、阴道),通常会导致粘膜疾病。此外,C. albicans也可以从人体肠道传播到血液中,并侵入内脏器官,产生侵袭性的、危及生命的感染。尽管C. albicans感染通常发生在免疫系统较弱的个体,如器官移植接受者或接受化疗的癌症患者,并且在欧洲,侵袭性念珠菌病的发病率较低。饮食和饮酒。由于许多真菌被用于酿酒厂和食品工业,饮食可能对人类肠道真菌菌群存在影响。研究表明,这种影响是广泛且复杂的,特别是对于特定的食物类别。饮食的影响是双重的。一方面,许多含有真菌的食物,如酵母,可能是肠道中真菌的来源。另一方面,已知某些营养物质(如糖)可以促进特定真菌种类的生长。本研究表明,饮食相关因素(包括饮酒)是真菌菌群变异的最重要的协变量之一。各种饮食相关因子水平的差异对肠道菌群α多样性的影响也是最广泛的。不同组间的差异也体现在β多样性上。此外,许多真菌种类与各种饮食相关因素呈正相关或负相关,并且许多真菌种类在组间有显著的倍数变化。对肠道菌群的研究表明,菌群的变化与近期摄入食物的组成有关,这与以往研究强调的肠道细菌种群变化主要与长期饮食有关形成了鲜明对比。在之前基于人类肠道微生物组项目的研究中,Candida与高碳水化合物饮食呈正相关,但与高氨基酸、蛋白质和脂肪酸饮食呈负相关。此外,Candida的高丰度与近期碳水化合物的摄入密切相关。Saccharomyces的高流行率与食用含酵母的食物(如啤酒和面包)有关。宿主性别。尽管在动物和人类中,性别引起微生物组成的差异越来越明显,但到目前为止,研究主要集中在细菌上,很少关注两性之间真菌组成的确切差异。同时,与细菌相似,两性间真菌组成的差异可归因于性激素在调节微生物组成中的作用以及饮食以性别依赖性方式改变微生物组成。尽管有这些假设,但我们观察到的男性和女性在真菌菌群上的唯一差异是在同质性水平上(Pilou指数),女性受试者的菌群更同质。在Strati等人进行的一项肠道真菌组成的研究中,基于宏基因组学分析对每个分析样本中真菌丰富度的测量也显示男性和女性受试者之间没有显著差异。相比之下,基于上述研究的分析结果显示,与男性相比,女性肠道真菌种类增加。然而,作者在这项研究中没有发现任何被调查年龄组的男性和女性个体物种数量之间的显著差异。他们只观察到Aspergillus和一些Tremellomycetes_unidentified_1在男性受试者中明显多于女性。此外,与我们的结果相反,之前报道的女性真菌物种的多样性更大。值得注意的是,这种关联只发生在年轻人而不是中年人中,而且,正如我们的研究一样,受试者大多是中年人。这可能是我们没有观察到男性和女性之间这种差异的原因。年龄。年龄和微生物组结构之间的关系是关于肠道菌群研究最多的课题之一。尽管研究表明,肠道菌群多样性最明显的变化发生在儿童早期,但也有报道称其在成年期增加,对不同年龄组肠道菌群的分析显示,年轻人的肠道菌群α多样性指标有所上升,这一趋势在40岁左右停止。但需要指出的是,本研究是基于16S rRNA基因测序,因此重点研究的是细菌群落。先前描述的关于人类真菌菌群与年龄关系的调查显示,婴儿(0-2岁)和儿童(3-10岁)肠道真菌菌群的丰富度高于成人(18岁)。分析还显示,在成年期,真菌菌群也可以观察到变化,老年人(46-65岁)的真菌菌群Shannon多样性高于其他调查组。此外,在本研究中,与老年人相比,真菌种类的差异最大。我们还报告了在所有被调查年龄组之间的单个真菌物种水平上的几个变化。这些结果表明,年龄是研究肠道真菌菌群时应考虑的一个重要因素。BMI。对瘦弱和肥胖小鼠的研究表明,肠道菌群影响能量平衡,影响热量消耗的效率以及能量的使用和存储方式。肥胖与细菌多样性水平的显著降低有关。此外,在肥胖个体中观察到Candida数量增加。肠道真菌Candida parapsilosis最近被确定为与小鼠饮食诱导的肥胖相关的关键共生真菌。这一发现似乎印证了我们对人类的研究结果,因为D. hansenii和S. paradoxus属于体重超标者与体重过轻者相比具有正对数倍数变化的物种。D. hansenii在肠道真菌菌群中的高丰度可能与肥胖和超重人群的饮食习惯有关,因为D. hansenii是所有类型的奶酪和香肠中的常见物种。然而,在这一点上,仍然不清楚异常的体重增加是由特定的真菌引起的,还是肠道真菌菌群的变化是肥胖和超重个体高能量饮食转变的结果。健康。临床研究表明,肠道微生物组组成与人类健康(不同疾病)相关。微生物组组成与某些疾病的风险增加有关,如肥胖、儿童过敏、糖尿病和炎症性肠病,并在患有自闭症谱系障碍的儿童中发生改变。在本研究中,只有自身免疫性疾病影响受试者真菌菌群的整体特征,具有更高的肠道真菌菌群丰富度和Shannon多样性。有趣的是,患有自身免疫性疾病的受试者的D. hansenii丰度明显较低。到目前为止,D. hansenii在人类健康中的作用尚不清楚。D. hansenii最近与克罗恩病联系起来,它能阻止肠道愈合,并对大鼠的类风湿关节炎有影响。本研究提示了D. hansenii对自身免疫性疾病的影响,尽管需要进一步的研究来更深入地研究这种关系。本研究还发现一些物种在消化系统疾病(如反流、肠易激和胃灼热)中的丰度下降,即S. paradoxus、N . crassa、Z. mraki、C. dubliniensis、A. oryzae、M. restricta和A. fumigatus。这些结果似乎相互矛盾,因为人们普遍认为,真菌毒素作为真菌代谢产物会导致胃肠道屏障和免疫功能紊乱,因此与消化问题有关。然而,考虑到一些物种如S. cerevisiae还可以对人体健康产生积极影响,甚至可以作为益生菌,不排除已鉴定的物种也可以对人体肠道产生积极作用。因此,它们数量的下降可能会导致消化问题。在个体真菌物种水平上,抑郁症的变化最为多样化,N. crassa、B. cinerea、U. maydis、S. paradoxus、M. restricta和A. oryzae增加,Z. mrakii和A. fumigatus减少。在过去的十年中,肠道菌群对心理健康(包括抑郁症)的影响引起了人们的极大关注,并提出了几种肠道菌群与心理健康之间双向影响的机制。然而,研究主要集中在肠道菌群的细菌部分,即使有一些证据表明肠道真菌菌群-大脑轴是合理的,但仍然缺乏对肠道真菌菌群影响大脑的潜在机制的理解。关于真菌菌群与抑郁症的关系,Jiang等人研究了当前抑郁发作(CDE)患者的菌群。他们发现,CDE患者肠道真菌菌群的α多样性相对减少,而与我们的结果类似,基于Shannon指数的α多样性和β多样性在CDE和健康组之间没有显著差异。此外,CDE组的Candida水平高于对照组,Penicillium水平低于对照组。本研究首次在物种水平上显示了抑郁症患者肠道真菌菌群的多样化变化模式。在我们的分析中,属于Aspergillus属的两种真菌A. fumigatus和A. oryzae被检测到在抑郁的受试者中具有相反的变化模式。此外,Jiang等人表明,基于8个属(4个细菌属和4个真菌属)组合的肠道微生物指数将CDE患者与对照组区分开来,这表明肠道微生物组特征是一种很有前景的疾病分类工具。值得注意的是,Jiang等人和我们的研究都是观察性的,抑郁症患者的样本数量很少(分别为24和30)。为了确定肠道真菌菌群在抑郁症中的作用,未来需要进行涉及更大群体的宏基因组研究,并伴随着代谢组学分析。药物的使用。抗生素对肠道细菌组成的有害影响是有据可查的,但它们对真菌群落的影响不那么明显,也没有被广泛研究。从理论上讲,共生菌可能通过几种机制限制真菌的定植和入侵,如产生抗真菌化合物,对可用营养物质的竞争,趋化性和对局部环境的物理化学变化。因此,针对细菌的药物可能是真菌感染的一个基本风险因素。在一项关于抗生素对肠道真菌菌群影响的研究中,证明了抗生素给药会引起肠道细菌的显著变化,从而导致真菌丰度的长期变化。虽然细菌群落在抗菌治疗后30天内大部分恢复,但真菌群落已经从互利共生转变为竞争。然而这项研究的规模很小,只分析了14名参与者。迄今为止,大多数研究都集中在病原真菌上。已有研究表明,厌氧菌特异性抗生素或广谱抗生素对真菌敏感性有不同的影响,尤其是C. albicans。另一项研究表明,共生真菌如C. albicans或S. cerevisiae可以在抗生素暴露后功能性地取代细菌失调的肠道细菌。抗生素相关性腹泻患者的胃肠道中有念珠菌过度生长。另一方面,食疗和抗生素似乎可以减少克罗恩病患者真菌种类的丰度。在本研究中没有观察到肠道真菌菌群组成在α-和β-多样性方面的变化。然而,在单个物种的水平上的变化是明显的。近期服用抗生素与较高丰度的Z. mrakii、A. fumigatus和A. oryzae相关。A. fumigatus是一种致病菌,抗生素治疗后其流行率较高是不可取的。这对于免疫缺陷的受试者尤其危险,因为A. fumigatus是免疫抑制个体侵袭性真菌感染的最常见原因。局限性。本研究的主要局限性在于描述性质和关联并不能证明因果关系。我们的一些结论具有推测性和相关性,因此,需要进一步研究肠道真菌菌群与宿主因子之间的因果关系,以及下游机制。此外,我们只从个体中采集了单个样本,并且没有跟踪肠道真菌菌群随时间的变化。因此,确定观察到的真菌群落在人们肠道中随时间变化的代表性需要进一步研究。此外,对肠道中特定真菌物种丰度的估计是间接的,因为它是基于粪便样本,这些粪便样本不能完全代表粘膜相关的真菌群落,并且在生物学意义上可能存在差异。然而,尽管存在这些局限性,但大量人类数据支持的大群体多组学分析可以显著提高我们对宿主相关因素背景下肠道真菌菌群生态学的理解。正因为如此,他们可以迅速提出潜在的有价值的途径,进一步研究肠道真菌菌群及其对人类健康的影响。
结论
与细菌群落相比,人类肠道真菌菌群的数量和多样性较低(占所有微生物群的1%),以酵母菌为主,包括Saccharomyces、Malassezia和Candida。虽然研究队列中的受试者间变化很大,但大多数样本中都存在几种真菌物种,这证明了核心肠道真菌菌群的存在。此外,本研究还发现,与宿主相关的因素,如饮食、年龄和婚姻状况,会影响肠道真菌菌群的变异性,从而影响人类健康。据我们所知,这是第一个在肠道真菌菌群与这种全面和分化的宿主相关因子的关联方面进行分析的大型欧洲队列。此外,除了肠道真菌菌群α-和β-多样性水平的总体差异外,我们的分析还揭示了许多研究因素在真菌物种水平上的丰度变化。在即将到来的精准医疗肠道微生物组时代,对不同真菌结构的功能后果的进一步研究值得深入研究。
原文链接:https://journals.asm.org/doi/full/10.1128/msystems.00986-22?af=R
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。



















