NAT REV NEUROL(IF:44): 肠道菌群在多发性硬化症中的作用
时间:2023-02-15 来源:《微生态》公众号 作者:微生态 浏览次数:3823导读
在过去的十年中,研究表明,栖息在肠道中的大量微生物群(称为肠道微生物群)与人类健康和疾病有着复杂的联系,部分原因是其对系统免疫反应的影响。越来越多的证据表明,这些微生物群对免疫功能的影响在神经炎性疾病(如多发性硬化症(MS))中很重要,并且在这些情况下调节微生物组可能是有益的。本篇综述研究了肠道菌群通过调节肠道中5-羟色胺的产生以及通过与免疫系统组分(如T细胞和B细胞)的复杂相互作用对免疫功能的影响。然后,我们从小鼠和人类的研究中得到的证据表明肠道菌群对免疫系统的这些影响在MS的发展和进程中是重要的。我们还考虑了如何使用操纵肠道菌群组成的策略来影响与疾病相关的免疫功能障碍,并形成新一类治疗方法的基础。讨论的策略包括使用益生菌、补充细菌代谢物、移植粪便或确定的微生物群落,以及饮食干预。需要精心设计的大型人群队列研究,以充分了解MS中涉及的微生物组变化,并制定针对这些变化的治疗策略。
论文ID
原名:The role of the gut microbiota in multiple sclerosis
译名:肠道菌群在多发性硬化症中的作用
期刊:Nature Reviews Neurology
IF:44.711
发表时间:2022.8
通讯作者:Sergio E. Baranzini
通讯作者单位:美国加利福尼亚大学旧金山分校
DOI号:10.1038/s41582-022-00697-8
综述目录
主要内容
在过去十年中,对人体肠道微生物组的研究迅速加快,揭示了栖息于多个身体生态位的微生物群,尤其是肠道微生物群与人类健康有着复杂的关系。围绕这些微生物群及其基因组组成(称为微生物组)及其对人类健康和疾病的影响的研究兴趣已经扩展到医学的各个领域,包括神经病学。自身免疫和炎症状况及其动物模型,特别是多发性硬化症(MS)及其动物模型实验性自身免疫性脑脊髓炎(EAE),是微生物组研究证明重要基本概念并开始提出新的治疗途径的首批疾病之一。
1 微生物群和免疫系统
神经炎性疾病,如涉及免疫功能障碍的MS,微生物群的改变可以以多种方式影响免疫功能。首先,细菌代谢物影响肠道5-羟色胺的产生,5-羟色胺本身调节许多免疫细胞类型的功能。此外,通过与免疫系统的多个组成部分的复杂相互作用,肠道微生物群对调节宿主T细胞和B细胞的成熟和活性起着重要作用。反过来,这些淋巴细胞通过维持肠道屏障和低级微生物向其他身体部位移位来调节微生物群。这些相互作用始于肠上皮,共生(和致病)细菌通过穿透粘液层进入肠上皮。这种粘液层在小肠和结肠中是不同的,这与居住在两个区域的肠道相关淋巴组织中的免疫细胞的组成和功能有关,即促炎性淋巴细胞主要在小肠中产生,而抗炎性淋巴细胞则主要在结肠中产生。
微生物群的信号在上皮细胞、树突状细胞、巨噬细胞和先天性淋巴细胞之间产生复杂的相互作用。正常情况下,这些相互作用受到先天性和适应性免疫反应的严格控制。然而,由于生态失调引起的肠道内稳态的破坏可能导致系统免疫反应失调。考虑到系统免疫过程可导致MS和其他神经炎性疾病的神经炎,这种失调可导致和/或加重神经炎症(图1)。在下面的小节中,我们将详细讨论微生物群如何影响免疫功能,以及在小鼠和人类中的研究如何证明这些影响在神经免疫疾病中是重要的。
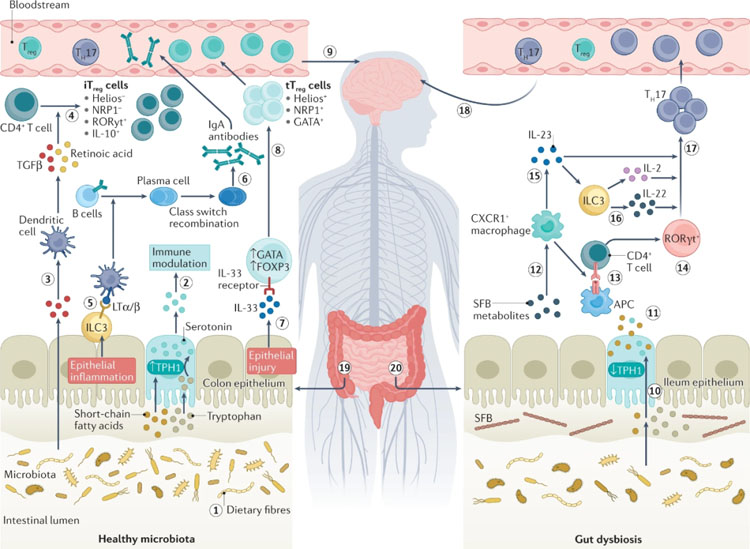
1.1 血清素
1.1.1 肠道中的微生物和血清素产生
血清素是由饮食中的色氨酸代谢产生的。这种代谢由5-羟色氨酸脱羧酶、色氨酸羟化酶1(在肠道嗜铬细胞中)和色氨酸羟化酶2(在大脑中)介导。动物研究表明,肠道微生物可以通过调节色氨酸羟化酶1的表达来影响肠嗜铬细胞合成的5-羟色胺的量。
在无菌环境中饲养的小鼠(无菌小鼠)血浆色氨酸水平高于在特定无病原体条件下饲养的小鼠,血清素水平较低,这是维持实验小鼠菌落的常规方法,这些水平在断奶期后的菌落中恢复正常。正常化与色氨酸羟化酶1的表达增加相关,而肠嗜铬细胞的数量没有变化。此外,向小鼠施用短链脂肪酸(SCFA;源自膳食纤维的微生物代谢产物)增加了肠嗜铬细胞中色氨酸羟化酶1 mRNA的水平,随后在不改变5-羟色胺转运体水平的情况下增加了肠道5-羟色胺水平。这一观察结果表明,微生物群通过其代谢产物调节5-羟色胺的产生。结肠给药色氨酸羟化酶抑制剂阻断了微生物群产生结肠和外周血清素的能力,这表明肠道微生物需要宿主色氨酸羟化酶活性来上调外周血清素的产生。
1.1.2 血清素与神经炎症
几乎在所有类型的免疫细胞上都发现了血清素受体,越来越多的数据表明,在神经炎期间,肠道血清素通过不同的机制影响先天性和适应性免疫系统。例如,肠道中5-羟色胺水平的增加通过减少IFNγ的产生和T细胞增殖来减轻小鼠EAE的严重程度,MS患者CD4+ T细胞上5-HT1A受体的表达增加,血清素抑制了体外CD8+ T细胞释放IL-17和IFNγ,两者在MS中都具有神经毒性。
除了对T细胞的作用外,血清素还可以激活单核细胞上的5-HT2B和5-HT7受体,上调与M2巨噬细胞极化相关的基因,抑制脂多糖诱导的促炎细胞因子。此外,体外激活星形胶质细胞中的5-HT4受体可抑制IFNγ介导的主要组织相容性复合体(MHC)II类和共刺激分子的诱导。这些效应可能会干扰中枢神经系统(CNS)中星形胶质细胞的免疫反应。血清素还可以通过5-HT3受体激活自身反应性T细胞,从而增加IL-6和IL-17的产生,从而对EAE产生有害影响。
除了血清素对各种免疫细胞的直接作用外,血清素代谢物还具有免疫抑制作用。对EAE小鼠的研究表明,N-乙酰血清素通过激活TrKB受体而具有抗氧化、抗炎和神经保护功能。褪黑素是血清素的另一种代谢物,可改善EAE,并通过诱导转录因子Nfil3的表达来干扰人和小鼠T细胞的分化,从而阻断TH17细胞的分化,并通过激活Erk1/2信号和IL-10启动子RORα的转录来促进保护性Tr1细胞的分化。
1.1.3 微生物群和CNS血清素
肠道微生物群是否影响中枢神经系统中5-羟色胺的局部效应尚不清楚。色氨酸可以通过同源L型氨基酸转运体穿过血脑屏障(BBB),从而在中枢神经系统中产生局部血清素。然而,5-羟色胺本身是一种带电分子,不能被动地穿过细胞膜,因此需要一种运输机制才能穿过BBB,而目前还没有发现这种转运机制。因此,微生物群对外周血清素产生的调节不太可能影响中枢神经系统中的血清素水平。
1.2 T细胞
1.2.1 对促炎性T细胞的影响
特定的共生细菌种类可以调节肠道相关淋巴组织中的CD4+ T细胞区系,并促进促炎性T细胞(TH1或TH17细胞)的产生。在对EAE耐药的无菌小鼠中,TH17细胞是检测不到的,但分节丝状菌(SFB)的单殖促进了TH17细胞的分化和扩增,其中许多细胞对SFB抗原具有特异性,从而恢复了对EAE的敏感性。同样,在复发缓解型MS患者中,小肠粘膜中促炎性IL-22+IL-17+细胞水平增加与链球菌菌株相关。此外,一项研究表明,与MS特异性相关的细菌种类可以促进炎症过程,多发性硬化症患者中增加的Akkermansiamuniciphila和Acinetobacter calcoaceticus在人外周血单个核细胞中诱导促炎反应。3型先天性淋巴细胞(ILC3s)也通过释放IL-22响应IL-23促进TH17细胞的产生,IL-23在SFB代谢物激活后由巨噬细胞分泌。
1.2.2 对调节T细胞的影响
调节T(Treg)细胞是抗炎的,这些细胞和促炎T细胞之间的平衡决定了免疫反应的强度。肠道含有肠诱导Treg(iTreg)细胞和胸腺诱导(tTreg)细胞(图1)。iTreg细胞在结肠中富集,在共生细菌及其代谢物的存在下在结肠中扩张和分化。在无菌小鼠中不存在iTreg细胞,它们在小肠和结肠固有层中的产生是由不同的微生物群落成分诱导的,包括梭菌簇IV和XIVa以及大肠杆菌、拟杆菌、乳杆菌和链球菌属微生物。这些物种中的许多存在于肠道的特定区域,导致iTreg细胞的区室化活化和诱导,这对肠道CD4+T细胞稳态至关重要。细菌SCFA是重要的代谢产物,通过作用于粘膜CD103+树突状细胞,促使CD4+ T细胞分化为iTreg细胞。因此,这些结肠树突状细胞产生极化因子TGFβ和维甲酸,并抑制促炎细胞因子的表达。
肠道中产生的Treg细胞进入循环并影响全身免疫反应。通过这种方式,局部微生物群通过对Treg细胞水平的影响影响全身炎症过程,进而影响神经炎症。共生菌群影响神经炎症的一个特定途径是通过CD39调节Treg细胞活性,从而增加Treg细胞的迁移能力(从而促进CNS的功能),并调节免疫细胞和外周的嘌呤能信号。星形胶质细胞和小胶质细胞中的嘌呤能信号传导在病理过程的发展中是一个特别重要的因素。
1.2.3 粘膜相关恒定T细胞
1.3 B细胞
免疫球蛋白G是血清中主要的抗体同型,但血液中大量的抗体分泌细胞分泌免疫球蛋白a(IgA)抗体,这些抗体通常分泌到胃肠道等粘膜表面。在肠道内,浆细胞在稳态期间产生大量对抗共生细菌的IgA抗体。这些浆细胞的发育由ILC3s启动,它对由微生物群驱动的上皮细胞产生的IL1β作出反应。激活的ILC3s分泌淋巴毒素α和β,以及粒细胞-巨噬细胞集落刺激因子(GM-CSF),它们反过来作用于树突状细胞和巨噬细胞,启动下游级联,导致B细胞分化。然而,一些证据表明,产生肠道抗原特异性IgA抗体的细胞也存在于肠道外。一项对小鼠的研究表明,肠道来源的IgA+ B细胞从肠道中被动员,随后减轻CNS的炎症(图2)。这一发现表明,应该考虑这些细胞在自身免疫性疾病中的作用。
后续调查显示,在活动性MS中,肠道菌群特异性的IgA+ B细胞进入中枢神经系统。在本研究中,研究人员在MS和其他神经炎性疾病患者的肠道、血液、脑脊液和脑组织中鉴定了产生IgA的B细胞和IgA抗体。在MS患者中,肠道细菌的IgA涂层与健康对照组不同,这增加了MS相关细菌是有效IgA诱导剂的可能性。有趣的是,活动性复发期间脑脊液中IgA+ B细胞和IgA抗体水平高于临床缓解期间;鉴于IgA+ B细胞已被证明在大脑中具有抗炎作用,这一观察结果表明它们在炎症疾病活动期间保护大脑。这些发现与观察结果一致,即在稳态状态下,肠道培养的产生IgA的浆细胞在小鼠真菌感染时保护脑膜静脉窦。
这些数据表明,B细胞和肠道微生物群之间的串扰是探索MS和潜在的其他神经炎性疾病的新途径。鉴于B细胞耗竭是目前治疗复发缓解型MS的最有效方法,微生物群在调节B细胞功能方面的作用引起了极大的兴趣。
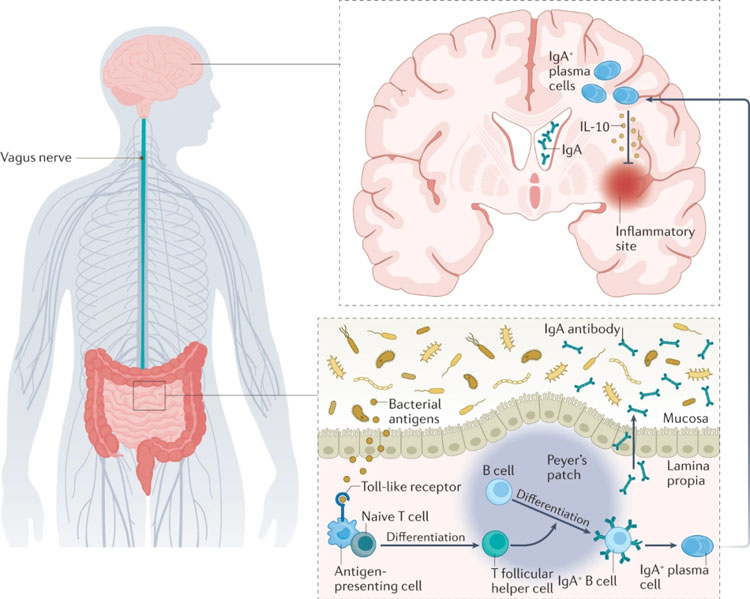
图2. MS中产生IgA的浆细胞的再循环。细菌抗原激活抗原呈递细胞,导致原始T细胞分化为T滤泡辅助细胞。这些细胞进而促进B细胞分化为IgA+ B细胞和产生IgA抗体的浆细胞。浆细胞和抗体进入血液循环,并通过浆细胞释放IL10减少大脑炎症。
1.4 微生物易位
最初,肠道微生物群和免疫系统之间的相互作用被认为主要是由于细菌产物和碎片穿过肠道上皮屏障,到达邻近的肠道相关淋巴组织。然而,使用现代技术对细菌进行敏感和特异性检测,包括培养、可视化和测序技术,已有证据表明,健康的非粘膜组织中存在易位的活细菌,挑战了健康哺乳动物在非粘膜部位是无菌的传统观点。此外,在一些自身免疫性疾病(包括系统性红斑狼疮和1型糖尿病)和肿瘤(包括胰腺、乳腺、骨骼和脑肿瘤)的肠外部位发现了易位共生细菌。目前尚不清楚MS中共生细菌是否会转移到肠道远端淋巴组织或中枢神经系统。
为了使共生细菌或其产物转移到肠道相关淋巴组织或肠道远端部位,它们首先需要穿过肠道上皮屏障,这对病理生理学和治疗至关重要。在EAE小鼠中,肠道通透性在疾病发作前增加,并且这种通透性随着疾病的进展而增加。屏障功能的破坏与粘膜结构的改变有关,包括空肠和回肠粘膜的隐窝深度和厚度的增加,以及zonulin 1的过表达,这些改变导致固有层、Peyer斑块和肠系膜淋巴结中TH1和TH17细胞驱动的促炎反应增加。除了肠道相关淋巴组织外,肠道远端淋巴组织(如淋巴结和脾脏)是易位活细菌或细菌产物可能与免疫系统相互作用的部位。
与MS特别相关的是肠道微生物群是否与BBB相互作用的问题。越来越多的证据表明,可以发生直接和间接的相互作用。一些细菌可以通过其细胞壁成分(如脂磷壁酸(LTA))与脑内皮的相互作用穿过完整的BBB。其他细菌需要BBB破坏或外周免疫细胞的参与,以促进其穿过BBB进入CNS。此外,脑内皮细胞表达Toll样受体,这意味着它们可以直接对细菌细胞壁组分(如脂多糖和LTA)的存在作出反应。脂多糖和LTA还可以诱导其他类型的细胞释放调节BBB功能的促炎介质。有趣的是,无菌小鼠的BBB通透性高于无特定病原体小鼠。这种通透性与紧密连接蛋白occludin和claudin 5的表达减少有关,这两种蛋白已知调节内皮组织中的屏障功能。成年无菌小鼠肠道菌群的定植降低了BBB通透性并上调了这些紧密连接蛋白的表达。总体而言,这些发现表明肠道菌群和免疫系统之间的串扰可以影响大脑内皮,从而可能引发和/或维持CNS的病理过程。
1.5 CNS免疫系统
2 MS中的微生物群
2.1 临床前证据
细菌可能在中枢神经系统自身免疫中发挥作用的早期迹象来自于观察:表达髓磷脂特异性T细胞受体的转基因小鼠在非无菌环境中饲养时产生自发EAE,而在特定的无病原体环境中则没有。当时,这些观察结果被解释为外部致病菌可能引发神经系统自身免疫疾病的证据。共生细菌在神经系统自身免疫性疾病中起作用的第一个证据来自于使用抗生素治疗减少自然肠道菌群的研究。抗生素治疗降低了肠系膜TH17细胞的水平,从而降低了EAE的严重性。这种效应依赖于一组不变的自然杀伤细胞的存在,这表明先天免疫机制参与了CNS自身免疫的微生物调节。在另一项开创性研究中,口服抗生素治疗可预防主动诱导的EAE,表明该治疗下调了促炎机制或上调了抗炎机制。随后的研究发现共生脆弱拟杆菌是一种保护性细菌,它通过脱落落荚膜多糖A发挥有益作用,荚膜多糖A通过Toll样受体2信号通路激活Treg细胞,从而抑制EAE。
这些早期研究中使用的抗生素治疗对主动诱导的EAE的调节有几个局限性。首先,EAE的主动诱导涉及用自身抗原加佐剂对实验动物进行免疫,这一过程以不可预测和非生理方式影响共生肠道菌群。第二,抗生素治疗不完全且短暂地减少了微生物群。第三,抗生素可能有脱靶效应,这可能会混淆数据的解释。其中一些限制可以通过使用无菌小鼠来克服,从而能够对没有微生物群或具有特定微生物群组成的小鼠进行研究。然而,当与自发性自身免疫疾病模型结合使用时,使用无菌小鼠提供了最大的优势,这使得研究微生物群在引发疾病中的作用成为可能。
2.2 MS患者的研究
来自动物模型的证据表明,微生物群与神经系统自身免疫疾病有关,这导致了对肠道微生物群在人类多发性硬化症中的作用的研究。在解释人类微生物群研究结果时,必须记住,粪便样本中的微生物大多来自肠腔,而粘液或上皮相关群体中的微生物相对较少,因此一些微生物的代表性不足或缺失。此外,样品的收集可导致选择性地消除强制性厌氧生物。通过活检获取十二指肠或结肠样本是对这些人群进行充分采样的一个有吸引力的策略,但出于伦理考虑,除非患者出于诊断原因而严格要求进行检查,否则无法通过结肠镜广泛采集样本。
第一代人类研究主要描述了患者和对照组之间微生物组成的差异,并没有提供机制上的见解。这些研究发现,MS患者中的一些细菌属,如Akkermansia、Prevotella和Methanobrevibacter发生了改变,首次证明人类肠道微生物群的组成部分可能有助于CNS特异性自身免疫。然而,这些早期研究并没有得出一致的结论。
第二代研究涉及更大和/或更明确的MS患者和对照组的队列,并开始探索机制问题。这些研究以两项互补研究为例,其中无菌小鼠被MS患者和对照组的粪便微生物群定植。其中一项研究涉及34对患MS不一致的同卵双胞胎,这意味着人类遗传学对个体微生物群的影响是可控的。肠道微生物组成分析表明,总体微生物谱相似,但一些细菌属(如Akkermansia)在未经治疗的MS患者中与健康双胞胎相比有所增加。当将参与者的粪便细菌引入上述无菌转基因自发EAE模型时,接受MS参与者细菌的小鼠自发EAE的发生率明显高于接受健康双胞胎细菌的小鼠。
另一项研究涉及71名未经治疗的MS患者和71名健康对照。对微生物群落的分析表明,微生物群落的总体多样性没有发生重大变化,但一些细菌分类群与MS显著相关。MS相关细菌Akkermansia muciniphila和Acinetobacter calcoaceticus在人外周血单个核细胞和单定植小鼠中诱导促炎反应。相比之下,MS患者的Parabacteroides distasonis减少,并刺激抗炎T细胞反应。最后,将患有多发性硬化症的患者粪便移植到无菌小鼠体内,会加剧主动诱导的EAE,并降低IL10+ Treg细胞水平,而健康对照组的移植则没有。
综上所述,这两项研究共同提供了人类肠道微生物群与CNS特异性自身免疫相关的第一个功能性证据。确切的机制尚不清楚,但与MS相关的微生物群变化可能包括缺乏保护性细菌和促进疾病的细菌过多。一些证据还表明,特定微生物可以根据空间和时间背景产生积极和消极的免疫调节作用。例如,多项研究已经确定Akkermansia是一种在MS相关微生物群中过度表达的细菌属,这些细菌可在体外和体内诱导促炎反应。然而,在不同的EAE模型中,Akkermansia物种似乎有助于形成一个保护环,因为其丰度在疾病高峰期很高,它诱导树突状细胞产生细胞因子,刺激Treg分化,从而改善疾病。这项研究表明,Akkermansia物种的增加是由临床症状高峰期microRNA miR-30水平的增加介导的,而口服miR-30也与Treg细胞的有益增加相关。此外,对小鼠溃疡性结肠炎、牙周骨质破坏、动脉粥样硬化和肝损伤以及人类肥胖的研究表明,阿克曼氏菌在这些疾病中具有保护作用。综上所述,这些数据表明阿克曼氏菌可以以看似相反的方式与宿主免疫系统相互作用。不同分类群、代谢物、局部细胞环境及其细胞因子环境之间相互作用的复杂调控网络可能是这些观察结果的基础,但需要进一步研究以了解其确切的机制。
此外目前有很复杂的情况,多发性硬化症中微生物群的变化可以在疾病发生之前和/或之后发生。因此,MS的不同阶段和/或表型可能与不同的肠道微生物群落有关。因此,研究人员也对与进展型MS相关的微生物群变化进行了调查,并发现了一些关联。原发性进展性MS与Butyricococcus的减少有关,Butyricococcus是一种孢子形成菌属,已知能产生SCFA,因此能够通过诱导Treg细胞来介导抗炎作用。在另一项研究中,原发性进展性MS与肠杆菌科和梭菌的水平增加以及Blautea和Agathobaculum的水平降低有关。同一研究表明,在所有形式的多发性硬化症中,Akkermansia的增加与较低的临床残疾评分有关。最后,宏基因组分析显示,与复发缓解型MS相比,继发性进展型MS中参与DNA错配修复的微生物基因的存在增加。本研究中的硫代谢组学分析也显示粪便氧化过度,综合证据表明肠道中DNA氧化增加,这可能导致继发性进展型MS的慢性神经炎症和神经退行性变。
鉴于MS的广泛异质性和共生微生物群的巨大复杂性,显然需要进行第三代规模更大、更全面的微生物群研究,以深入了解微生物群在MS中的作用。必须仔细控制这些研究,以确保研究结果更加全面。例如,饮食是影响肠道微生物群组成的最重要因素,因此病例和对照组需要在饮食方面进行平衡,以确保微生物群组成中的任何差异与疾病相关,而不是与饮食的差异相关。除了饮食,肠道微生物组的组成也会受到年龄、性别、种族、地理位置和环境因素(例如吸烟和锻炼)等因素的影响。这些因素的组合意味着微生物群的组成部分与疾病之间的关联通常太小,无法解释在表型中观察到的大部分变异。需要进行大型、多中心对照研究,以尽量减少这些因素的影响,并更确切地确定关联。
为了生成这些数据,国际多发性硬化症微生物组研究(iMSMS)于2015年成立,是一项全球性的研究,旨在确定肠道细菌及其基因在MS中的作用。iMSMS的直接目标是分析数千名MS患者及其家庭中健康对照者的粪便样本。
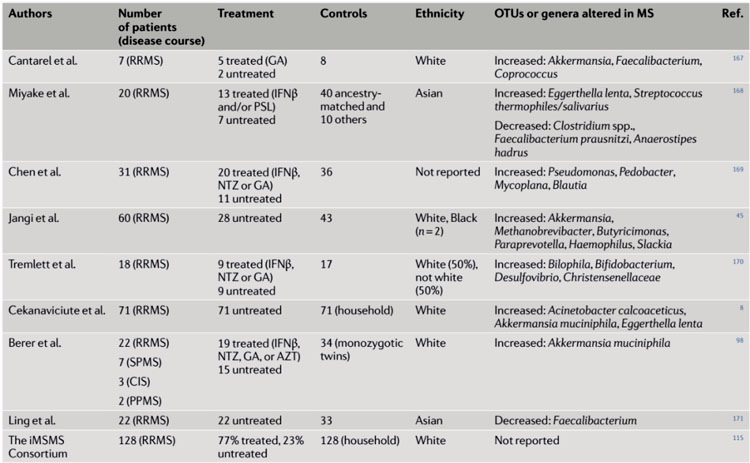
表1. 已确定多发性硬化症中微生物群改变的研究。
3 治疗意义
3.1 饮食
值得注意的是,短期、丰富性的饮食干预已经证明了快速改变人类微生物多样性的能力。然而,这些变化是短暂的,不会持续超过几天。长期的饮食模式和习惯性摄入在塑造每个人的微生物群方面都起着一定的作用。然而,尚不清楚需要维持多久的饮食干预才能实现微生物群的永久改变。已经提出了各种饮食方案来抑制复杂疾病的进展,其中一些有益的效果可能与其对肠道微生物群的影响有关。在多发性硬化症中,已经提出了几种可以减少炎症并促进临床改善的饮食干预措施;这些干预措施包括生酮饮食、旧石器时代饮食(以及改良版)和间歇性禁食等。
生酮饮食主要由高脂肪(55-60%)、中等蛋白质(30-35%)和极低碳水化合物(0-10%)组成。几项关于生酮饮食治疗多发性硬化症的研究和三项试点临床试验表明,这种饮食是安全可行的,可以起到神经保护和改善疾病的作用。
抗炎饮食以水果、蔬菜、瘦肉蛋白、坚果、种子和健康脂肪为基础。对100名复发缓解型MS患者进行了改良版抗炎饮食的研究,以研究其对疲劳、生活质量和炎症标志物的影响。饮食干预与改良疲劳影响量表评分和MS生活质量量表的生理和心理成分评分的显著改善相关。试验还显示,血清中抗炎IL-4水平略有增加,但在统计学上有显著性差异,IL-17和C反应蛋白水平没有明显变化。
最后,间歇性禁食包括持续时间超过一晚的禁食期,饮食限制在特定的时间窗口,有或没有卡路里限制。临床前研究表明,间歇性禁食和限时进食对肠道微生物群和宿主代谢有着深远的影响,而有限数量的人类对照试验也产生了类似的结果。这些微生物群变化对MS的影响尚待研究。
3.2 益生菌
通过使用益生菌补充肠道微生物群中的促进健康的细菌已被提议作为维持肠道完整性和预防病理改变的干预措施。根据2001年联合国粮食及农业组织(FAO)和世界卫生组织(WHO)的专家研讨会,益生菌是“当给予足够量的益生菌时,会给宿主带来健康益处的活体微生物”。体外和动物模型研究表明,益生菌可介导多种有益作用的机制,包括诱导宿主细胞抗菌肽、益生菌释放抗菌因子、抑制免疫细胞增殖和增强肠道屏障功能。
来自动物模型的证据表明,益生菌可以通过促进免疫细胞分泌IL-10和TGFβ,增加肠道相关淋巴器官和中枢神经系统中Treg细胞的数量,同时降低TNF、IFNγ和IL-17水平,从而减轻EAE。尽管有这些有希望的临床前数据,但没有强有力的证据表明益生菌对MS或任何其他疾病有益处。在一项针对MS患者的研究中,益生菌的施用增加了已知在MS中减少的几个分类群的丰度,例如乳杆菌物种,并降低了之前与MS相关的其他物种的丰度,包括Akkermansia和Blautia物种。然而,这些发现需要慎重考虑,因为纳入的患者数量较少,随访时间短,结果测量有限。
3.3 短链脂肪酸和其他代谢物
SCFA是链长为1至6个碳原子的饱和脂肪酸。它们是共生肠道菌群在食物纤维发酵过程中产生的主要代谢产物。乙酸盐、丙酸盐和丁酸盐是人体中最丰富的SCFA,在结肠中最重要。在人体肠道中,拟杆菌分泌大量的乙酸盐和丙酸盐,而厚壁菌门细菌主要分泌丁酸盐。SCFA不仅是肠道微生物群本身的重要能量来源,也是肠上皮细胞的重要能量源。越来越多的证据表明,SCFA在微生物群-肠道-大脑相互作用中起着关键作用。
SCFA对宿主免疫系统有多种影响。这些作用的机制之一是抑制组蛋白去乙酰酶(HDACs),从而导致巨噬细胞和树突状细胞的抗炎作用,并增加Treg细胞的产生。这些作用对于维持免疫稳态至关重要。在EAE小鼠中,丙酸盐的施用通过增加Treg细胞的数量来改善病程。向无菌小鼠施用丁酸盐可增加结肠固有层中Treg细胞的数量,并诱导树突状细胞和巨噬细胞分泌IL-10。SCFA对HDACs的抑制是浓度依赖性的,因此需要在人体内建立SCFA与HDAC抑制之间的剂量-反应关系。此外,还发现SCFAs通过抑制NFkB的活化而具有抗炎作用。
大多数现有证据表明,SCFA具有有益的免疫调节作用,尤其是在神经系统疾病中,但一些证据表明,它们也可能具有有害作用。例如,在一项研究中,尽管SCFA水平高于生理水平,但系统给药SCFA引起了肾系统T细胞反应的改变和组织炎症。在另一项研究中,丙酸增加了脂肪分化过程中GPCR43的表达,从而上调了PPARγ,这表明SCFAs在脂肪形成中具有重要的生理作用,这是有害的,因为脂肪组织促进炎症。此外,乙酸盐被转化为乙酰辅酶A,因此乙酸盐水平的增加导致细胞代谢中乙酰辅酶A的可用性增加,这可以促进mTOR活化,从而增加促炎性TH1、TH17和IL10+ T细胞的生成。
SCFA并不是影响系统免疫的唯一微生物衍生物。由色氨酸酶介导的色氨酸的细菌代谢产生多种代谢物,包括色胺、吲哚乙酸、3-甲基吲哚、吲哚-3醛和吲哚-3硫酸盐。这些分子可以与配体诱导的转录因子AHR结合,后者由免疫细胞、上皮细胞和星形胶质细胞表达,AHR的激活可促进Treg细胞或TH17细胞的生成,这取决于作用配体和免疫细胞微环境。基于这一知识,饮食中补充色氨酸代谢物是一种可能的治疗方法。在EAE小鼠中,这种膳食补充剂改善了EAE的症状。这种效果与AHR介导的细胞毒性酶一氧化氮合酶和趋化因子CCL2在星形胶质细胞中的抑制有关。类似地,抗生素抑制色氨酸酶阳性罗伊氏乳杆菌(Lactobacillus reuteri)以降低色氨酸代谢物水平会恶化EAE评分。未来的研究将重点放在色氨酸代谢物对AHR的调节上,这将有助于进一步阐明在这一途径中进行治疗干预的潜力。
3.4 粪便微生物群移植
粪便菌群移植是在接受高剂量广谱抗生素后,将健康供体的粪便内容物引入患者体内(通常通过结肠镜检查)的一种程序。其原理与器官移植相似,目的是纠正由疾病引起的生物失衡状态。在一项随机临床试验中,这种简单的程序对艰难梭菌感染有效,粪便微生物群移植可防止90%的患者再次感染艰难梭菌,而万古霉素仅能防止27%的患者复发。随后,粪便微生物群移植被考虑用于被认为是生态失调导致发病的疾病。在人类身上进行或正在进行的研究数量有限,而且仅对某些疾病进行了动物实验,需要进行大规模、双盲、随机、对照试验,以进一步阐明粪便微生物群移植对神经系统疾病的影响。对可重复性、可扩展性和安全性的担忧可能会限制这一前景看好的程序的发展。例如,供体粪便材料的异质性可能导致结果的不期望的变异性。此外,供体材料需要仔细测试是否存在已知病原体,尽管传播已知(或未知)病原体的风险无法完全消除。
4 人类微生物群的研究
随着肠道微生物群对人类健康的影响越来越明显,人们越来越有动力去了解微生物群如何进行治疗性改变,并制定干预措施来实施这些改变。然而,这类研究需要细致的研究设计,以确保结果准确且有意义。首先,要回答的问题必须经过仔细考虑并高度集中,试图在一项研究中回答太多问题可能是一个错误。如果目标范围太广,研究设计可能会变得过于复杂和/或对亚组的分析能力不足。一旦确定了研究问题,就可以选择合适的研究设计。医学微生物组研究中最常用的研究设计包括横断面研究、病例对照研究、纵向研究和随机对照试验。前三种是观察性研究,因此不使用干预,而最后一种是最广泛使用的干预性研究。
对于微生物群的研究,横断面研究可以是描述性的或分析性的。描述性研究用于调查一个或多个群体中微生物群的组成,而分析性研究则探讨微生物群与特定病理学之间的关联。横断面研究通常用于探索微生物组的特征,并作为未来研究的初步步骤。
病例对照研究和前瞻性纵向研究可以提供信息,但其有效性在很大程度上取决于所调查的风险因素的性质。当病例和对照组之间的暴露风险和相对风险较高时,病例对照研究是有用的,但MS中的微生物组研究并不总是如此,因此需要大样本量。此外,由于选择偏倚、报告偏差和反向因果关系的组合,病例对照研究的结果可能具有误导性。在规划和解释MS微生物群的病例对照研究时,需要考虑这些方面。
结论
在动物模型和人类疾病中的许多研究表明,肠道微生物组组成的改变可以影响CNS生理学和神经炎症,不仅在多发性硬化症中,而且在广泛的不同病症中,包括阿尔茨海默病、帕金森病、中风、脑损伤和神经精神疾病,如抑郁症、自闭症和精神分裂症。中枢神经系统中的神经和免疫活动可受微生物群衍生代谢物或微生物群衍生的系统信号的影响。然而,尽管有越来越多的证据,但我们对健康和疾病期间肠道和大脑之间沟通的确切机制的理解上仍存在相当大的差距。因此,需要进行更多的转化和临床研究来确定这些相互作用的改变是如何开始并持续的。小鼠模型对于从机制上深入了解微生物群在中枢神经系统疾病中的作用至关重要,但在足够大的人群队列中进行的研究对于识别有害和有益细菌至关重要。在进行转化和反向转化研究时,必须牢记物种之间在生理和解剖学上的根本差异,特别是在胃肠道和免疫生理以及环境因素(如居住条件和饮食习惯)方面的差异。
还需要对人类进行纵向研究,以确定靶向微生物群是否是可行的治疗策略。这些研究应包括微生物群的表征,并结合基因组、蛋白质组和代谢组学分析来确定与疾病有关的肠道微生物群的产物、它们影响调节宿主免疫功能的信号通路,以及特定影响中枢神经系统的细菌代谢物。这些见解不仅对于理解神经炎症的病因至关重要,而且对于识别诊断生物标志物和开发新的治疗方法也至关重要,其中调节肠道微生物群的组成以恢复免疫介导的中枢神经系统疾病中的免疫细胞稳态。
https://www.nature.com/articles/s41582-022-00697-8
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







