PHARMACOL RES: 抗生素诱导的肠道菌群损耗加剧宿主高胆固醇血症
时间:2022-12-12 来源:微生态 作者:微生态 浏览次数:3648导读
高胆固醇血症是动脉粥样硬化的主要驱动因素,导致了全球高发病率和高死亡率的发生。肠道微生物群已被确认为血脂(包括胆固醇水平)的调节剂。少数研究已经将部分细菌和微生物机制与宿主胆固醇相联系,然而在特定的小鼠模型中,根据遗传学和实验方法所得到的结果却是相互矛盾的。为进一步了解肠道细菌和宿主胆固醇代谢之间的关系,我们首先在一个人群队列(n=24)中进行了粪便16S rRNA靶向宏基因组测序,结果显示高胆固醇血症患者的肠道微生物群组成发生改变,包括双歧杆菌(Bifidobacteria)减少、梭菌(Clostridia)增加以及厚壁菌门/拟杆菌门比例增加。为检测对肠道微生物群的药物干预是否会影响宿主血清胆固醇水平,我们使用口服非吸收性抗生素治疗高胆固醇血症载脂蛋白E基因敲除(ApoE KO)小鼠。结果显示,当小鼠正常饮食且在随机喂食状态下测量血清胆固醇时,抗生素增加了血清胆固醇水平,由其引起的胆固醇升高在治疗开始后几天就已经发生,并且在停止抗生素并重新获得肠道细菌后是可逆的。基因表达分析表明,喂食状态下抗生素介导的肠道胆固醇摄取增加。非靶向血清代谢组学表明,植物甾醇水平降低和胆汁酸循环减少均与微生物机制有关。综上所述,本研究进一步揭示了肠道微生物群与宿主胆固醇代谢之间的关系;抗生素对肠道微生物群的药理破坏能够加重血清胆固醇并可能影响心血管疾病。
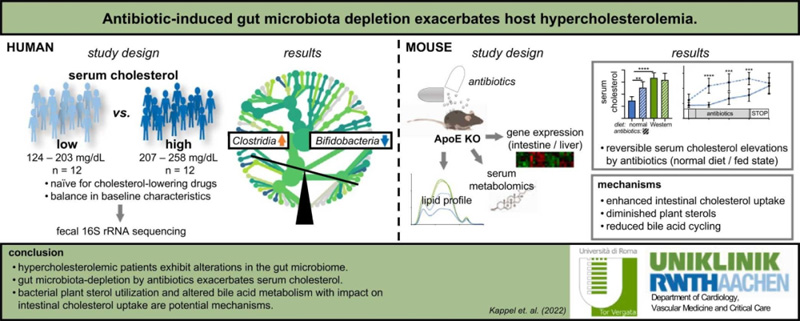
图文摘要
论文ID
原名:Antibiotic-induced gut microbiota depletion exacerbates host hypercholesterolemia
译名:抗生素诱导的肠道菌群损耗加剧宿主高胆固醇血症
期刊:Pharmacological Research
IF:10.334
发表时间:2022.11.21
通讯作者:Massimo Federici
通讯作者单位:意大利罗马第二大学
DOI号:10.1016/j.phrs.2022.106570
实验设计
结果
为了比较LC和HC组间粪便微生物群落结构分类差异,同时考虑到分类的层次结构,我们使用非参数Wilcoxon秩和检验进行热树分析,发现在HC患者中厚壁菌门(Firmicutes)增加,且是由梭菌目(Clostridiales)增加所介导的。相反,与LC相比,HC患者中属于放线菌门(Actinobacteria)的双歧杆菌目(Bifidobacteriales)大幅减少(图1a、b,S1a)。考虑到这两组间top OTU差异,双歧杆菌属(Bifidobacterium)、毛螺菌科(Lachnospiraceae)以及瘤胃球菌科(Ruminococcaceae)是先前观察结果的最主要驱动因素(图1c)。我们发现HC患者体内拟杆菌门(Bacteroidetes)的数量没有显著减少,但这导致了厚壁菌门与拟杆菌门的比率(Firmicutes/Bacteroidetes)显著升高(P<0.05,S1b)。此外,两组之间α多样性没有差异(S1c)。
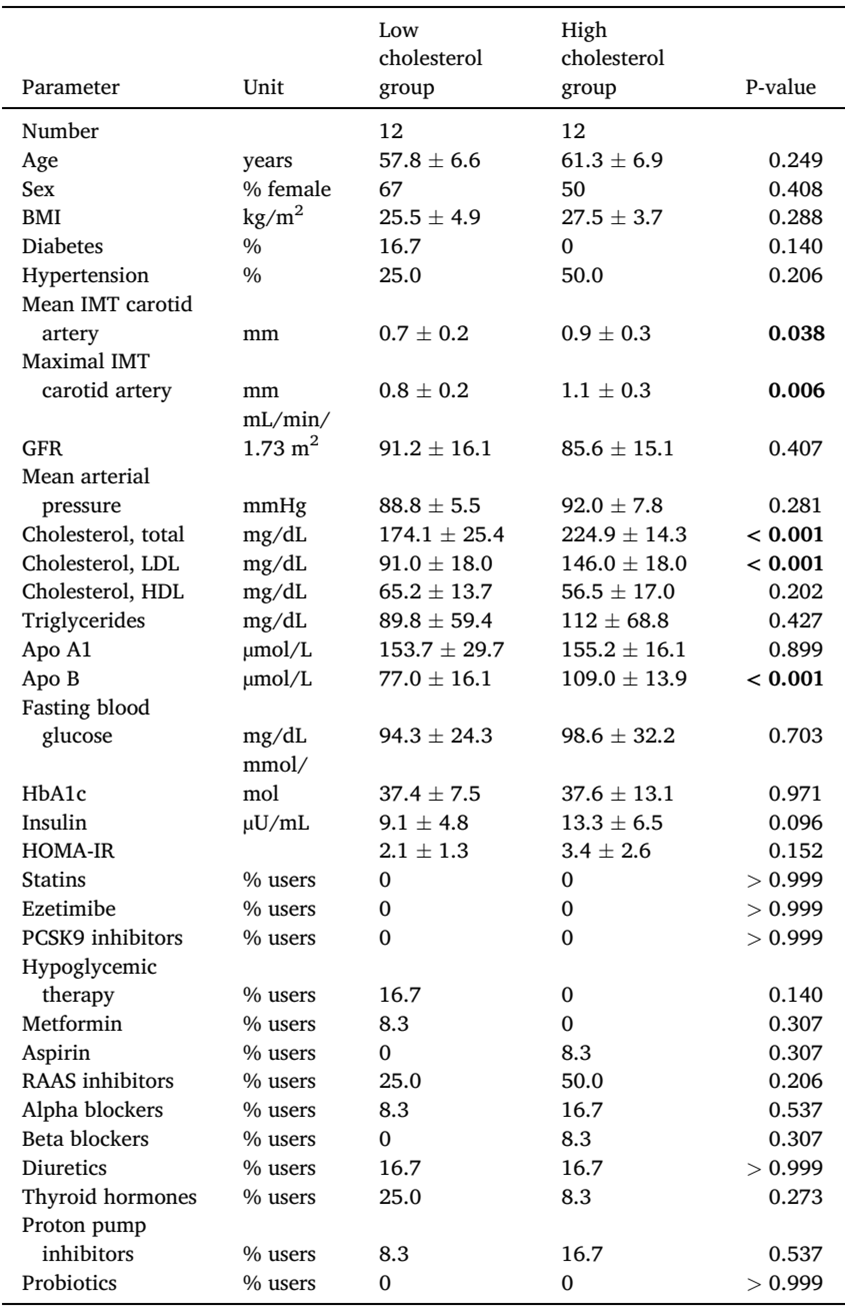
分类变量采用双侧t检验或卡方检验分析。数据为平均值±标准差。加粗字体表示差异显著即P < 0.05。Apo:载脂蛋白;BMI:身体质量指数;GFR:肾小球滤过率;HbA1c:糖化血红蛋白;HDL:高密度脂蛋白;HOMA-IR:稳态模型胰岛素抵抗指数;IMT:内膜中层厚度;LDL:低密度脂蛋白;PCSK9:前蛋白转化酶枯草溶菌素9;RAAS:肾素-血管紧张素-醛固酮系统。
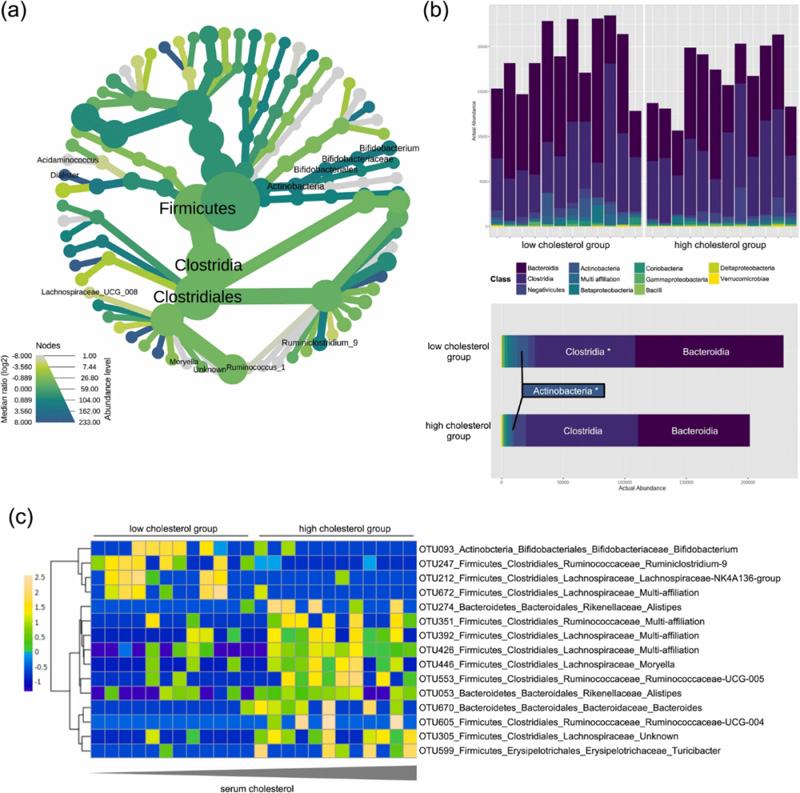
图1. 高、低血清胆固醇患者中肠道微生物群差异分析(n=24)。(a)热树显示群落结构差异,节点和边缘的大小及颜色与每个群落中生物丰度相关。标记显著的分类单元名称(Wilcoxon秩和检验P<0.05);(b)纲水平丰度分析。*Wilcoxon秩和检验P<0.05。(c)显著(P<0.05)操作分类单元(OTU)的热图。
鉴于LC和HC患者粪便的分类学差异,我们研究了微生物群靶向药物干预对血清胆固醇水平的影响。此前我们已经报道了在禁食状态下测量ApoE KO小鼠血清胆固醇时,口服抗生素治疗不会改变其血清胆固醇。然而,在这项研究中,我们重复了在随机喂食状态下血清胆固醇的测量,我们发现,口服抗生素会加重正常饮食(ND)小鼠的总胆固醇水平,而不是西方高胆固醇饮食(WD)小鼠的胆固醇水平(图2a)。为了证实这一观察结果,我们对血清脂蛋白进行了靶向高效液相色谱分析,包括亚类和粒径。结果显示,ND患者的低密度和极低密度脂蛋白胆固醇因抗生素而增加,而WD患者则没有显著变化(图2b、c,表2)。ND患者中乳糜微粒亚类(>90 nm)和高密度脂蛋白胆固醇(~7.6 nm)也因使用抗生素而略微增加(表2)。虽然WD患者中脂蛋白甘油三酯未被抗生素改变,但我们发现抗生素导致了WD患者中游离甘油的增加(图2b、C,表2)。
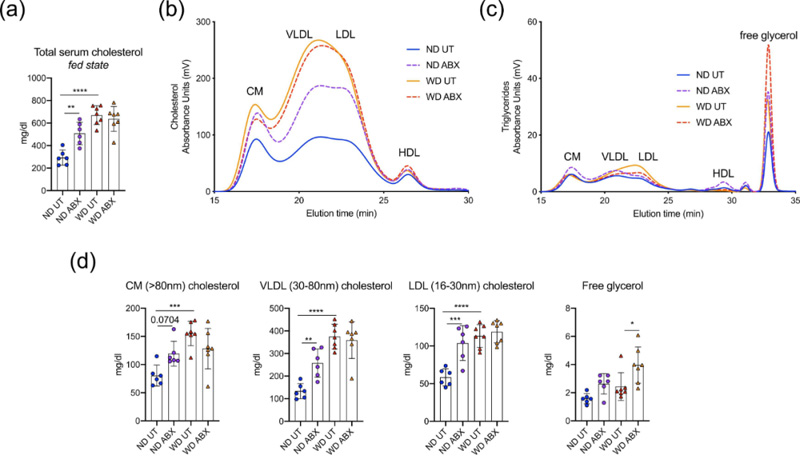
图2 动脉粥样硬化载脂蛋白E基因敲除小鼠脂质谱分析(n = 6,7只/组)。(a)喂食状态下的总血清胆固醇;(b)高分辨率血清脂蛋白胆固醇谱;(c)高分辨率血清脂蛋白甘油三酯谱,包括游离甘油;(d)乳糜微粒(CM)、极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)胆固醇和游离甘油的详细分析。HDL:高密度脂蛋白;ND:正常饮食;WD:西方饮食;UT:未处理;ABX:抗生素处理;双因素方差分析(Tukey事后检验),*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
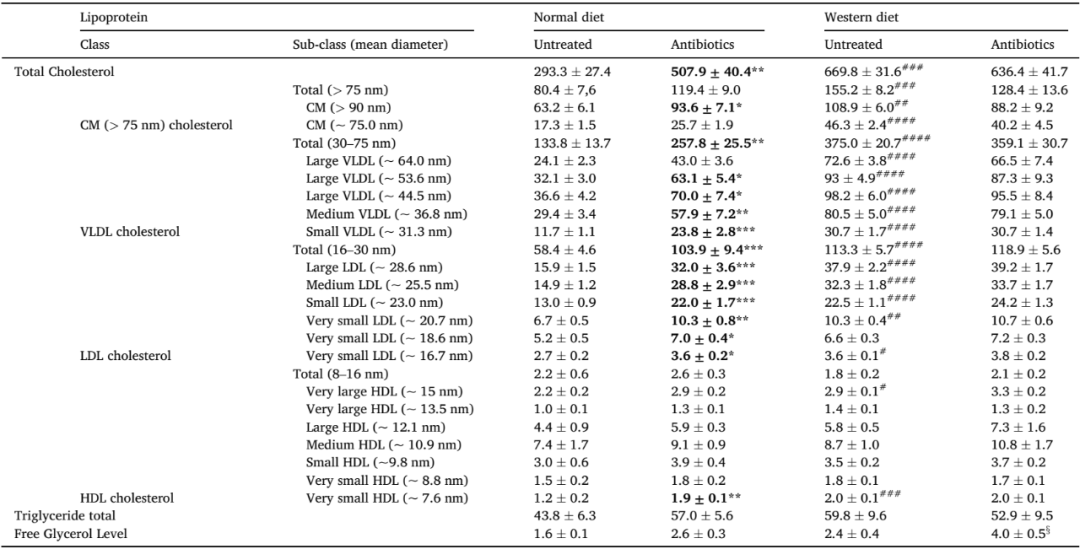
N=6-7/组。单位:mg/dL。使用2-way ANOVA及Tukey事后检验分析。正常饮食未处理与抗生素处理相比:*P<0.05,**P<0.01,***P<0.001(显著加粗);未处理的正常饮食与西方饮食相比:# P < 0.05, ## P < 0.01, ### P < 0.001;西方饮食未处理与抗生素处理相比:§ P < 0.05。CM:乳糜微粒;VLDL:极低密度脂蛋白;LDL:低密度脂蛋白;HDL:高密度脂蛋白。
3 抗生素引起血清胆固醇升高发生迅速且可逆
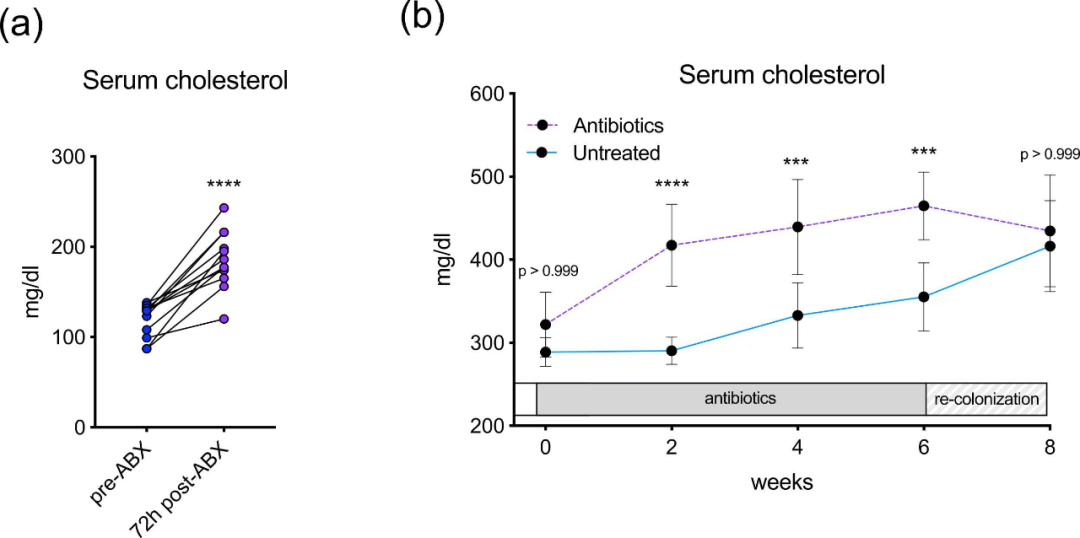
图3. 载脂蛋白E基因敲除小鼠中血清胆固醇对抗生素反应随时间变化的分析。(a)短期使用抗生素(ABX)治疗后血清胆固醇的变化,n=12,通过双侧配对t检验分析****P<0.0001;(b)抗生素使用前、使用期间和停止使用(再定植)后血清胆固醇的变化。数据为平均值±标准差,n=6–12,***P<0.001。
小肠和肝脏是维持胆固醇稳态的关键器官。为揭示抗生素引起血清胆固醇升高的机制,我们通过RT-qPCR对长期口服抗生素(ND或WD)的ApoE KO小鼠小肠和肝脏中与脂质代谢相关的基因进行了基因表达分析。热图结果显示,在肝脏中,饮食对基因表达有很大影响,而抗生素仅调节少量基因(图4a)。相反,在小肠中,抗生素显著影响ND和WD中的基因表达,特别是与肠道脂质代谢相关的常见基因,例如Nr1h3、Serbf1和Cd36均在抗生素处理后增加(图4a)。同时部分与胆固醇代谢相关的基因在ND和WD中也因抗生素处理而增强(Sbrebf2、Lldr、Hmgcr)(图4b),而大多数胆固醇代谢基因仅在ND中因抗生素而增强(Npc1l1、Pcsk9、Cyp27a1、Cyp51、Hmgcs1)(图4b)。
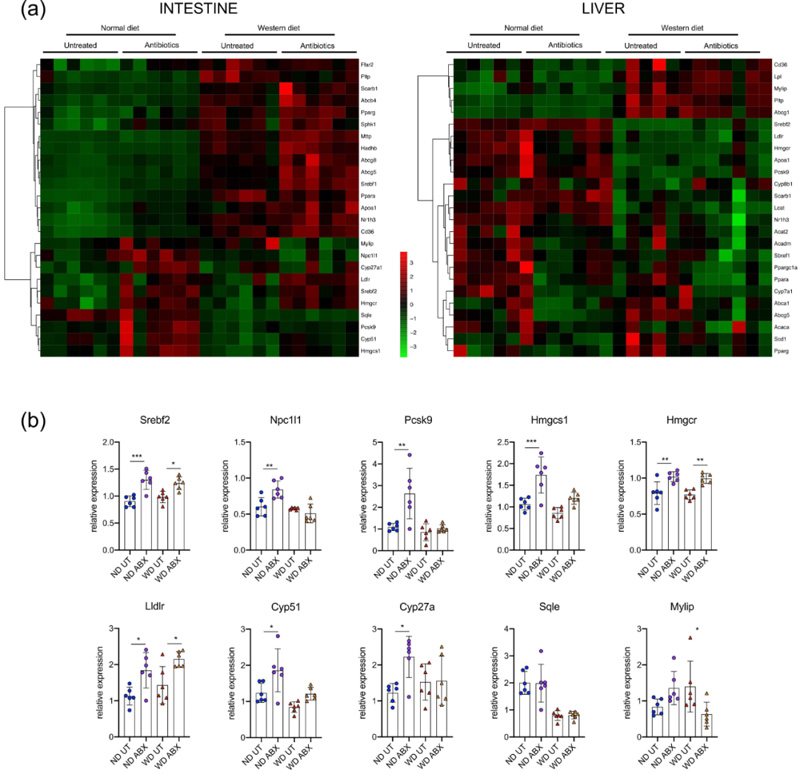
图4.载脂蛋白E基因敲除小鼠在不同饮食和抗生素处理下肝脏和肠道代谢基因的表达。(n=6/组)。(a)肝脏和肠道中脂质代谢相关基因的热图分析;(b)肠道中胆固醇代谢相关基因。ND:正常饮食;WD:西方饮食;UT:未处理;ABX:抗生素处理;*P<0.05,**P<0.01,***P<0.001,使用2-way ANOVA与Tukey事后检验。
5 抗生素可调节血清中植物甾醇和胆汁酸的水平
随后我们研究了抗生素可能引起血清胆固醇升高的代谢变化。在先前的研究中,对与饮食无关的血清代谢组变化将抗生素治疗、动脉粥样硬化的加剧相关联已经进行了评估。在本研究中,我们评估了抗生素作用下与胆固醇代谢相关的代谢物的变化(图5a)。通过非靶向代谢组学测定的游离胆固醇证实了先前的结果(图5b),然而,抗生素并没有改变胆固醇的合成,其前体3-羟基-3-甲基戊二酸水平不变(图5b)。有趣的是,在WD组中未检测到植物甾醇β-谷甾醇和菜油甾醇,但在ND中由于抗生素处理而显著减少(图5c)。此外,我们观察到ND患者经抗生素治疗后胆固醇通过胆汁酸排泄减少的趋势,表现为7α-羟基-3-氧代-4-胆甾烯酸(7-HOCA) (P =0.0645)、初级胆汁酸胆盐(P=0.0658)、β-muricholate(P<0.05)以及次级胆汁酸脱氧胆酸(P=0.0812)、牛磺脱氧胆酸 (P = 0.0521)、熊去氧胆酸、7-酮基脱氧胆酸(P<0.05)减少(图5d、e)。4-胆甾烯-3-酮(粪甾醇的前体)保持不变(图5d)。
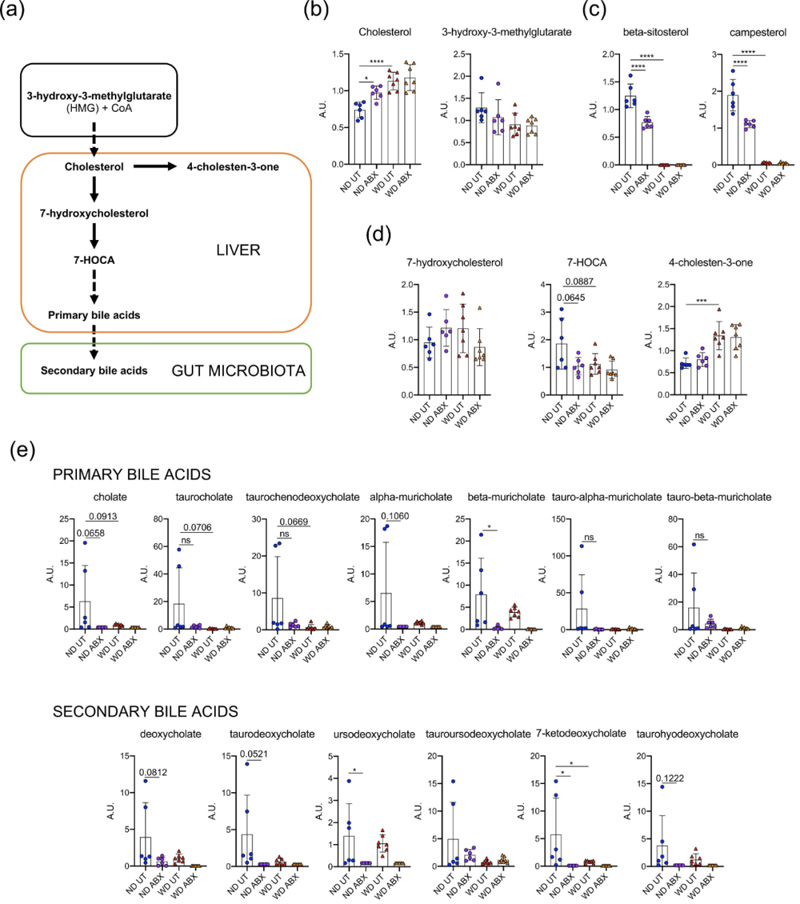
图5. 载脂蛋白E基因敲除小鼠血清代谢组学分析胆固醇代谢产物(n=6-7/组)。(a)通路;(b)游离胆固醇及其前体;(c)植物甾醇;(d)胆固醇的分解代谢产物;(e)胆汁酸。ND:正常饮食;WD:西方饮食;UT:未处理;ABX:抗生素处理;*P<0.05,**P<0.01,***P<0.001。
讨论
https://www.sciencedirect.com/science/article/pii/S1043661822005163
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







